香豆素为黄花草木樨( Melilotus officinalis)水浸提液的主效化感物质,能抑制多种杂草种子的萌发和幼苗生长。为探明香豆素的化感抑草作用机理,本研究采用室内培养、生物检测的方法,研究了简单香豆素水溶液对苏丹草( Sorghum sudanense)种子萌发及其幼苗生长和生理生化指标的影响,并采用透射电镜观察了苏丹草幼苗根和茎的超微组织结构。结果表明,20~100 μg·mL-1香豆素水溶液能够显著抑制早期苏丹草种子的萌发 ( P<0.05),且随浓度升高抑制作用增强,能够显著抑制苏丹草根伸长,随处理时间的延长和浓度的升高其抑制作用也增强,根变粗扭曲,而对茎长的影响存在浓度效应和时间效应,在4 d时,20~100 μg·mL-1浓度的香豆素水溶液均促进茎长,6和8 d则表现为低浓度促进、高浓度抑制;与加蒸馏水的对照组相比,100 μg·mL-1香豆素溶液处理显著( P<0.05)提高了过氧化氢酶(CAT)活性,并降低了超氧化物歧化酶(SOD)活性,对过氧化物酶(POD)抑制作用表现为先降低后升高;香豆素处理显著( P<0.05)提高了可溶性糖的含量,同时显著( P<0.05)降低了叶绿素的含量;在香豆素处理下,淀粉含量先降低后升高,吲哚乙酸氧化酶(IAAO)活性仅在第4天时低于对照组。香豆素水溶液破坏了苏丹草根细胞的超微结构,出现液泡体积变大,细胞器数量和种类减少的现象,细胞核的核膜发生明显的歪曲,细胞核变小甚至消失;香豆素水溶液处理下的苏丹草幼苗叶绿体内淀粉粒数目显著( P<0.05)增加,体积变大。以上结果显示,100 μg·mL-1的香豆素水溶液可以通过改变苏丹草抗氧化酶系统、增加渗透调节物质、降低叶绿素含量、影响酶活性以及破坏细胞超微结构等途径调节苏丹草的生长。
Coumarin is the main allelochemical of Melilotus officinalis, and can inhibit seed germination and seedling growth in a variety of weeds. In this study, we aimed to explore the allelopathy mechanism of coumarin and its inhibition of grass. Petri dish experiments were conducted on Sorghum sudanense to study the effect of coumarin on the main growth and physiological and biochemical indices, and to observe ultrastructural changes in the roots and stems by transmission electron microscopy. The following results were obtained. Coumarin concentrations in the range of 20 to 100 μg·mL-1 significantly ( P<0.05) inhibited the early germination of S. sudanense and the degree of inhibition increased with an increase in coumarin concentration. Coumarin solution significantly ( P<0.05) inhibited root length, and with an increase in treatment time and coumarin concentration, the roots became more coarse and distorted. There were concentration and time effects on stem growth. At 4 d, a coumarin concentration of 20~100 μg·mL-1 promoted stem length, whereas at 6 and 8 d, a low coumarin concentration promoted stem length and a high concentration inhibited stem length. A 100 μg·mL-1 coumarin solution significantly ( P<0.05) inhibited the growth of S. sudanense, and the germination rate, root length, and stem length were all significantly ( P<0.05) lower than in the control group; Coumarin solution significantly ( P<0.05) increased the activity of catalase and reduced the activity of superoxide dismutase, whereas the activity of the peroxidase initially decreased and then significantly ( P<0.05) increased. Coumarin solution significantly ( P<0.05) enhanced the content of soluble sugars and reduced the content of chlorophyll. Furthermore, treatment with coumarin initially decreased and then increased the content of starch, and the activity of indole acetic acid oxidase in coumarin-treated plants was lower than that in the control group. Treatment with coumarin solution destroyed the ultrastructure of Sudan grass root cells, with vacuole volume becoming larger, the number and types of organelles decreasing, the nuclear membrane being distorted, and the nuclei becoming smaller or even disappearing. Coumarin treatment also significantly ( P<0.05) increased the number of starch granules in the chloroplast of S. sudanense and their volume became larger. The above results indicate that 100 μg·mL-1 coumarin solution can regulate the growth of S. sudanense by changing antioxidant enzyme systems, increasing osmotic adjustment substances, decreasing chlorophyll content, affecting enzyme activity, and destroying cell ultrastructure.
近年来, 随着农药的使用量不断加大, 其弊端逐渐暴露[1, 2, 3, 4], 主要的问题是农药残留[5, 6, 7, 8]。利用植物化感物质抑制或者清除杂草是解决这一问题的有效途径之一[9, 10]。国内外研究表明, 很多植物对杂草表现出化感抑制作用, 例如水稻(Oryza sativa)的水浸提液可以减少田间稗草(Echinochloa crusgalli)以及鳢肠(Eclipta prostrate)等杂草[11]; 向日葵(Helianthus annuus)的水提液也可抑制稗草的生长[12]; 小飞蓬(Conyza canadensis)水浸提液可以抑制马唐(Digitaria sanguinalis)、稗草、反枝苋(Amaranthus retroflexus)和苘麻(Abutilon theophrasti)4种杂草种子萌发和幼苗生长[13]。目前该类研究成果已经进入田间试验评价阶段, 并取得了一定的成果。王海斌等[14]探讨了连续3年5种不同化感潜力水稻田间抑草效应、产量及其之间的相互关系, 发现水稻可以利用自身化感作用控制稻田杂草, 且不同化感潜力水稻对稻田杂草的抑制能力存在一定差异, 因此化感水稻在田间种植过程中可在保证相同成熟期下, 采取适当多品种种植的生态调控策略, 以提高水稻自身对多种类别杂草的防除效果或配以适当化学除草剂最终达到水稻的高产、优产和高效的目的。
有研究表明, 黄花草木樨(Melilotus officinalis)有很强的化感作用, 其水浸液能够显著抑制稗草、藜(Chenopodium album)、臭草(Melica scabrosa)、籽粒苋(Amaranthus hypochondriacus)、萹蓄(Polygonum aviculare)和车前草(Plantago asiatica)等杂草种子萌发和幼苗生长[15], 经气质联用(GG-MS)及核磁共振(NMR)鉴定出其主要化感物质为香豆素, 含量为46.78 μ g· mL-1, 且溶液中香豆素相对含量越高抑制作用越强。研究发现, 香豆素溶液在浓度为40 μ g· mL-1时能显著抑制多花黑麦草(Lolium multiflorum)、萹蓄、红三叶(Trifolium pratense)和紫花苜蓿(Medicago sativa “ Victoria” )等种子的萌发和幼苗生长, 当香豆素溶液浓度达到100 μ g· mL-1时, 几乎达到完全抑制[16, 17]。Razavi[18]研究发现, 香豆素含量在100 μ g· mL-1时能够完全阻碍生菜(Lactuca sativa)的种子出苗和其根、茎的生长。由此可见, 将香豆素开发为新型的除草剂[19]具有很大的潜力。
简单香豆素(C9H6O2)是香豆素类物质中以最简单形式存在的化合物, 与大部分香豆素类化合物性质相似, 因此通过研究简单香豆素, 对于更好地理解香豆素类化合物的作用机理具有重要意义。目前关于香豆素对植物的化感作用大多还是停留在发芽率等形态上的研究, 缺少对受体植物组织和细胞内部结构及其机理方面的报道。因此, 为了进一步探明香豆素的化感抑制作用机理, 本研究用不同浓度香豆素溶液对苏丹草(Sorghum sudanense)进行处理, 观察其种子萌发和幼苗生长过程中的变化, 并测定分析苏丹草100 μ g· mL-1浓度处理下的一些重要生理生化指标, 用透射电镜观察苏丹草根和茎细胞内部结构的变化, 为开发香豆素新型生物除草剂提供一些理论基础。
供体药品为简单香豆素, 固体香豆素购于SIGMA公司(编号:C4261-50G, 纯度≥ 99%)。苏丹草“ 布鲁诺” 为受体植物, 种子购于百绿集团。
香豆素水溶液的制备:准确称取100 mg香豆素标准品, 用水定容至1 L, 充分溶解后得到100 μ g· mL-1的香豆素水溶液, 于4 ℃冷藏备用, 要用时分别稀释至20、40、80 μ g· mL-1。
苏丹草的培养:在直径为12 cm× 12 cm的发芽盒中加入石英砂90 g, 将经1%次氯酸钠消毒30 min的苏丹草种子均匀播入发芽盒中, 每盒100粒, 向试验组每个发芽盒中加20 mL 100 μ g· mL-1的香豆素水溶液, 对照组加等量蒸馏水, 每个处理5次重复。然后采用完全随机区组设计, 放入25 ℃光照培养箱(智能光照培养箱ZGX-300C, 杭州钱江仪器设备有限公司)中进行培养, 培养条件的光/暗12 h/12 h, 光照强度4 000 lx[20]。
透射电镜样品前处理:选取播种处理后第4、6和8天已经发芽苏丹草的根和茎, 切割成1 mm× 1 mm× 1 mm左右的样品, 切割后立即放入戊二醛固定液抽真空, 放在冰箱里4 ℃固定24 h以上。经0.1 mol· L-1的磷酸盐缓冲液(pH=7.2)冲洗3次, 每次15 min, 然后使用1%锇酸固定4 h, 再使用0.1 mol· L-1的磷酸盐缓冲液冲洗3次, 每次15 min, 乙醇梯度脱水(30%、50%、70%、80%、90%、100%), 每次15 min, 进行常规树脂(美国SPI, 02660-AB)包埋, 在超薄切片机(徕卡, UC6)上用钻石刀切片, 再经醋酸铀和枸椽酸铅双重染色, 在Phillips Tecnai 12 TEM (荷兰)透射电镜下观察, 照相[21]。
出苗率:从第1天开始每天记录各处理下苏丹草出苗率, 直到第8天。
苗长与根长:播种4、6和8 d后从每个发芽盒中随机取10株苏丹草测定其根长及苗长, 取平均值。发芽数低于10株的只取发芽的幼苗测苗长和根长, 并取该相应幼苗的平均值[20]。
茎叶干重与根干重:播种4、6和8 d后从每个发芽盒中随机取10株苏丹草, 将幼苗的地上部分和地下部分分离, 105 ℃杀青3 h, 然后65 ℃烘干至恒重[20]。
植物全株过氧化氢酶(CAT)活性、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)、可溶性糖(soluble sugar)含量:播种4、6和8 d后采样, 使用试剂盒(南京建成生物有限公司)测定。
植物全株吲哚乙酸(IAAO)酶联免疫分析:播种4、6和8 d后采样, 使用试剂盒(上海心语生物科技有限公司)测定。
植物全株淀粉(starch)含量:播种4、6和8 d后采样, 采用蒽酮比色法[22]。
植物全株叶绿素含量、叶绿素a含量、叶绿素b含量:播种4、6和8 d后采样, 采用80%乙醇浸提法[22]。
试验数据先用Excel进行初步处理后, 用 SPSS 软件(SPSS Ver.17.0 for Windows)对数据进行单因素方差分析, 数据以算术平均数± 标准误表示, P< 0.05为差异显著性判断标准。
不同浓度香豆素水溶液对苏丹草种子的萌发有不同的抑制作用(表1), 且随着浓度的升高抑制作用增强, 在第5天时, 100 μ g· mL-1处理组低于对照组7.86%(P< 0.05)。同时, 香豆素水溶液处理出现发芽延迟、出苗不齐的现象。对照组根先萌发, 而处理组则茎先突破种皮。
| 表1 不同浓度香豆素溶液处理下苏丹草发芽率 Table 1 Seed germination rate of Sorghum sudanense under different concentrations of coumarin solution% |
注:不同大写字母表示同一时间不同浓度处理之间差异显著(P< 0.05), 不同小写字母表示同一香豆素浓度不同时间之间差异显著(P< 0.05), 下同。
Note:Different capital letters in the same sowing day indicate significant differences among different coumarin concentrations at the 0.05 level. Different lowercase letters in the same coumarin concentration indicate significant differences among different sowing days at the 0.05 level; similarly for the following figures and tables.
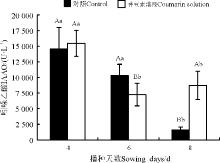
香豆素水溶液显著(P< 0.05)抑制苏丹草的根长, 浓度越高抑制作用越强, 且随处理时间的延长其抑制作用也增强, 根变粗扭曲(图1, 图2); 处理4、6和8 d后, 20 μ g· mL-1香豆素水溶液对苏丹草茎长均有促进作用, 4 d, 20~60 μ g· mL-1 香豆素处理显著(P< 0.05)促进苗长, 100 μ g· mL-1虽然也促进苗长, 但无显著影响(P> 0.05); 6 d, 40~100 μ g· mL-1抑制苗长, 但差异不显著(P> 0.05); 8 d, 20~80 μ g· mL-1促进苗长, 但无显著影响, 100 μ g· mL-1显著抑制苗长。
不同香豆素水溶液对苏丹草茎叶鲜重和干重均有促进作用(表2), 20~80 μ g· mL-1显著促进苏丹草茎叶鲜重(P< 0.05), 在100 μ g· mL-1浓度时恢复至对照水平, 20~60 μ g· mL-1显著(P< 0.05)促进苏丹草茎叶干重, 在80和100 μ g· mL-1浓度时恢复至对照水平; 20~60μ g· mL-1显著促进苏丹草根鲜重(P< 0.05), 80和100 μ g· mL-1浓度下则显著抑制苏丹草根鲜重, 20~100 μ g· mL-1浓度区间均抑制苏丹草根干重, 尤其在40~100 μ g· mL-1显著抑制苏丹草根干重的积累(P< 0.05)。
 | 图1 不同浓度香豆素水溶液对苏丹草幼苗根长和茎长的影响Fig. 1 Effect of different concentrations of coumarin solution on Sorghum sudanense root and shoot lengths |
 | 图2 不同浓度香豆素水溶液对苏丹草根的影响Fig. 2 Effect of different concentrations of coumarin solution on root of Sorghum sudanense |
| 表2 不同浓度香豆素溶液处理下苏丹草鲜重和干重 Table 2 Fresh weight and dry weight of Sorghum sudanense seedlings under different concentrations of coumarin solution |
香豆素溶液处理苏丹草种子后, 苏丹草植株内CAT活性发生了变化(表3)。处理4、6和8 d后, 处理组均高于对照组, 尤其在处理6和8 d, 处理组显著高于对照组(P< 0.05)。对照组苏丹草CAT活性随着时间的延长, 总体呈下降趋势且差异显著(P< 0.05), 香豆素处理的苏丹草CAT活性总体呈先升高后降低趋势, 处理6 d高于处理4 d (P< 0.05), 处理4 d高于处理8 d(P< 0.05)。处理4、6和8 d后分别比对照组提高11.56%、184.62%和1 085.71%。
香豆素溶液处理苏丹草种子后, 苏丹草植株内POD活性发生了变化(表3)。处理4和6 d后, 处理组均低于对照组, 处理8 d后处理组高于对照组。对照组和香豆素处理的苏丹草POD活性随播种天数的变化趋势总体呈先降低后升高趋势(P< 0.05)。处理4和6 d后, 处理组分别比对照组下降了32.79%和3.91%, 处理8 d后, 处理组比对照组升高了12.30%。
香豆素溶液处理苏丹草种子后, 苏丹草植株内SOD活性发生了变化(表3)。处理4、6和8 d后, 处理组均低于对照组, 但无显著差异(P> 0.05)。对照组苏丹草SOD活性随播种天数呈下降趋势, 处理组苏丹草SOD活性呈先升高后降低趋势, 但均无显著差异。处理4、6和8 d后, 处理组分别较对照组下降了5.41%、1.49%和0.24%。
| 表3 香豆素水溶液处理对苏丹草幼苗抗氧化代谢酶活性的影响 Table 3 Effect of coumarin solution on antioxidant enzymes activity of Sorghum sundanense seedings |
香豆素溶液处理苏丹草种子后, 苏丹草植株内IAAO活性发生了变化(图3)。处理4和8 d后, 处理组高于对照组, 处理6 d后处理组显著低于对照组(P< 0.05)。对照组的苏丹草IAAO活性总体呈降低趋势, 处理组苏丹草IAAO活性先降低后升高, 处理4 d显著高于处理6和8 d (P< 0.05)。处理4和8 d后, 处理组分别较对照组升高了6.24%和451.35%, 处理6 d后, 处理组较对照组下降了29.72%。
香豆素溶液处理苏丹草种子后, 苏丹草植株内可溶性糖含量发生了变化(表4)。香豆素处理4、6和8 d后, 处理组可溶性糖含量均显著高于对照组(P< 0.05)。对照组和香豆素水溶液处理的苏丹草可溶性糖总体均呈下降趋势, 且差异显著(P< 0.05)。香豆素溶液处理4、6和8 d后, 处理组分别比对照组提高了32.44%、48.87%和17.88%。
用香豆素溶液处理苏丹草种子后, 苏丹草植株内淀粉含量发生了改变(表4)。用香豆素处理4和6 d后, 处理组淀粉含量低于对照组(P< 0.05), 用香豆素处理8 d后, 处理组淀粉含量高于对照组(P< 0.05)。对照组和香豆素水溶液处理的苏丹草淀粉总体均呈下降趋势, 且差异显著(P< 0.05)。香豆素溶液处理4 d和6 d后, 处理组较对照组分别降低了18.91%、25.44%, 香豆素溶液处理8 d后, 处理组较对照组升高了39.78%。
| 表4 香豆素水溶液处理对苏丹草渗透性调节物质的影响 Table 4 Effect of coumarin solution on osmotic adjustment substances of Sorghum sudanense seedlings |
香豆素溶液处理苏丹草种子后, 苏丹草植株内叶绿素含量发生了变化(表5)。处理4、6和8 d后, 总叶绿素、叶绿素a和叶绿素b的含量处理组基本低于对照组(P< 0.05)。对照组和香豆素溶液处理的总叶绿素和叶绿素a含量均呈上升趋势, 叶绿素b在对照组呈上升趋势(P< 0.05), 在香豆素溶液处理下呈先升高(P< 0.05)后降低趋势。对照组中, 随着播种天数的延长, 总叶绿素、叶绿素a和叶绿素b含量显著升高(P< 0.05); 处理组中, 处理6 d的总叶绿素、叶绿素a和叶绿素b与4 d相比显著增加(P< 0.05), 处理6和8 d间无显著差异(P> 0.05)。处理4、6和8 d处理组的总叶绿素含量较对照组分别降低了47.06%(P< 0.05)、39.64%(P< 0.05)和63.04%(P< 0.05), 处理组的叶绿素a与对照组相比分别降低了46.15%(P< 0.05)、44.05%(P< 0.05)和63.04%(P< 0.05), 处理组的叶绿素b与对照组相比分别降低了50.00%(P< 0.05)、28.57%(P> 0.05)和58.14%(P< 0.05)。
| 表5 香豆素水溶液处理对苏丹草总叶绿素的影响 Table 5 Effect of coumarin solution on the chlorophyll content of Sorghum sudanense seedlings |
对照组中苏丹草幼苗的根细胞形态完整清晰, 整个细胞充满了均匀的细胞质, 内有完整的细胞核, 细胞器数量多且明显, 液泡呈正常大小(图4)。经100 μ g· mL-1的香豆素溶液处理后, 苏丹草幼苗根细胞的超微结构与对照相比有明显的变化(图4)。香豆素处理4 d, 与对照相比, 细胞内液泡体积变大, 细胞器数量和种类减少(图4); 香豆素处理6 d, 细胞内液泡与4 d处理组相比变得更大, 几乎占据整个细胞, 细胞器数量和种类继续减少, 对照中细胞核位置居中且核膜清晰, 核仁致密, 经处理后细胞核的核膜出现明显的歪曲, 细胞核变小(图4)。香豆素处理8 d, 细胞壁变薄, 液泡消失, 细胞核发生溶解, 仅存在少量的细胞器(图4)。结果显示, 随着处理时间的变长, 香豆素对于苏丹草细胞结构的破坏程度也增强。
对照组中苏丹草幼苗茎细胞形态完整清晰, 细胞壁与细胞膜紧密结合, 内有完整的细胞核, 液泡占据了大半个细胞, 细胞器数量多且明显(图4)。经100 μ g· mL-1的香豆素溶液处理后, 苏丹草幼苗茎细胞的超微结构与对照相比, 细胞结构和大小并不存在明显的变化, 但茎叶绿体内淀粉粒数目显著增加, 体积变大(图4), 表明苏丹草启动了自身防御功能。
种子萌发是植物生活周期中最脆弱且最重要的阶段, 种子是否成功萌发和正常成苗决定了植物的繁衍和生存[23]。种子的发芽率降低、发芽时间的延长以及出苗延后, 会大大影响植物在生态系统中的竞争能力[24]。本研究结果表明, 香豆素水溶液能够显著抑制苏丹草初期种子的萌发, 对根有明显的抑制作用, 且随浓度的增加抑制作用增强, 对茎叶的影响表现为“ 低促高抑” , 总体上对根长的抑制作用要比对茎长的抑制作用强, 这与周先容等[25]的结果一致, 可能是由于根的化感性要高于茎。在香豆素溶液处理, 根系首先受到不同程度的抑制作用, 导致根系变短变粗, 甚至发生形变, 阻止对养分和水分的吸收, 从而引起植物体内一系列生理生化反应。
植物在逆境胁迫下体内的
吲哚乙酸(IAA)是植物生长过程中一种重要的内源激素, 参与调节多种生理生化反应, 如细胞的分裂分化和扩大、根茎的生长发育、器官的衰老等。研究IAA的代谢主要是通过研究其代谢相关酶实现的。吲哚乙酸酶(IAAO)和过氧化物酶(POD)均是IAA分解代谢的相关酶。其中IAAO是降解IAA的关键性酶, 调节植物体内的IAA水平, 其活性与IAA负相关。当植物受到外界胁迫时, IAAO会在IAA代谢过程中表现出相应的作用和变化。胡拥军等[27]研究发现, 用100 mg· kg-1砷处理大叶井口边草(Pteris cretica)和剑叶凤尾蕨(Pteris ensiformis)两种植物叶片, 大叶井口边草在处理13 d时, IAAO活性显著降低, 在处理3周左右又恢复到原来的活性, 在之后总体呈先下降的趋势; 剑叶凤尾蕨在培养37 d时表现出短暂的显著降低, 之后IAAO活性总体上保持在较高水平。本研究与之类似, 随着播种时间的延长对照组IAAO呈下降趋势, 表明随着时间的延长体内IAA不断堆积, 从而促进了植物的生长; 处理组中IAAO随时间变长表现出动态变化, 6 d时IAAO显著降低, 在8 d后活性有所上升, 表明前6 d香豆素水溶液可能对IAAO影响小, 到8 d时香豆素水溶液才开始对IAAO产生较强的作用。
在逆境胁迫下, 植物细胞会通过积累大量的渗透调节物质来维持一定的渗透压, 维持水分平衡, 从而保持植物的光合作用、气孔的开合以及植物生长等生理过程的正常进行。可溶性糖在有机质代谢中具有重要的作用, 可以提高植物对逆境的抵抗能力, 张丽和白小娟[28]研究证明了在逆境胁迫下, 植物体内的可溶性糖含量升高。本研究中, 处理组的可溶性糖在4、6和8 d时均高于对照组, 推测苏丹草通过增加其含量提高自身的抵抗能力, 也可能是香豆素使得细胞内大分子糖类等降解为小分子可溶性糖。淀粉是贮藏在植物体内的高分子碳水化合物, 在种子发芽时, 种子胚乳中的淀粉水解成可溶性糖类, 进而经合成作用再构建植物体[29, 30]。本研究中, 香豆素溶液处理4和6 d时, 处理组中的淀粉含量均低于对照组, 在8 d时, 处理组高于对照组。推测在4和6 d时, 香豆素对苏丹草造成胁迫, 但胁迫力度不是很强, 可以通过分解淀粉来增强自身对胁迫的抵抗能力, 在8 d时, 香豆素对苏丹草的胁迫增强导致分解淀粉能力下降, 因此淀粉含量上升。
叶绿素是植物进行光合作用的物质基础, 涉及一系列复杂的生理过程。植物可以通过捕获光能来进行体内有机物的合成, 单位面积上叶绿素的含量可以反映植物光合能力强弱, 因此, 可以通过测定植物中叶绿素的含量来判断植物的生长状况[31]。很多研究表明逆境胁迫会打破植物正常的新陈代谢, 导致叶绿素含量下降[32, 33], 本研究得出了类似的结果, 在4、6和8 d时处理组的叶绿素含量均低于对照组。此外, 4-6 d的叶绿素增加量明显低于6-8 d的叶绿素增加量, 由此可见, 随着播种天数的增加香豆素对于苏丹草叶绿素的胁迫增强。
植物的形态结构是总是与环境相适应的。当植物受到环境胁迫后, 其细胞超微结构的变化是植物一系列生理生化活动异常的细胞学基础, 因此研究苏丹草受香豆素处理后细胞超微结构的变化, 对揭示香豆素对苏丹草化感作用机理有着重要意义。张黛静等[34]研究表明, 小麦(Triticum aestivum)幼根根尖在铜处理下细胞壁和细胞膜均受到破坏, 出现空泡现象, 部分细胞核、核仁及细胞器消失; 相关研究报道在高盐胁迫下的马铃薯(Solarium tuberosum)叶绿体内淀粉粒数目会明显增多, 体积变大[35]。本研究结果与该研究结果一致, 证明了香豆素可以通过破坏苏丹草的细胞结构来达到抑制其生长的目的。Mahmood等[36]用香豆素处理水稻根系也证明了这一结果, 香豆素破坏了其细胞膜和细胞结构导致电解质泄露。此外, 本研究表明, 随着播种天数的增加, 香豆素对苏丹草根系的破坏程度也增强, 并且香豆素对苏丹草根系的破坏力要强于茎, 这可能是由于根的化感性要高于茎。
香豆素对苏丹草种子萌发和幼苗生长的影响存在浓度效应。通过对香豆素胁迫下苏丹草生理生化指标和超微结构的研究发现, 100 μ g· mL-1的香豆素水溶液不仅可以降低苏丹草种子胚乳中的淀粉转化利用效率, 也会对细胞壁、细胞膜和细胞内部超微结构造成破坏, 从而导致种子萌动受阻。此外, 香豆素对苏丹草根的抑制作用要强于茎, 因此, 建议在实际应用中香豆素溶液应接近地面根部喷洒效果更佳。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|