第一作者:娄艳(1989-),女,甘肃临夏人,在读硕士生,研究方向为马铃薯遗传育种.E-mail:lou_yan0931@163.com共同第一作者:白江平(1978-),男,甘肃天水人,副教授,硕导,博士,研究方向为作物遗传育种.E-mail:baijp@gsau.edu.cn
为探究马铃薯( Solanum tuberosum)不同遗传特性与其对水分胁迫响应之间的相关关系,本研究通过SSR分析了供试材料的遗传多样性,并通过PEG-6000和不浇水胁迫处理马铃薯移栽苗的方法,研究了干旱胁迫下不同马铃薯品种中过氧化物酶(POD,CAT)活性及可溶性蛋白含量的变化.结果显示,在遗传相似系数(GS)为0.700水平上,44份马铃薯材料可被聚为5类,大部分品种聚在一起,说明供试品种的遗传基础相对狭窄.通过GGE-Biplot综合分析POD,CAT及可溶性蛋白质变化量,将44份供试材料分为6组.比对分析遗传多样性分析与生理结果,发现二者之间并不具有明显的一致性,即品种遗传特性的差异并不能直接反映品种的抗旱性能差异,而两种胁迫方式在研究品种抗旱特性上具有较高的一致性.该研究结果可以为今后抗旱试验的进行提供参考.
To explore the relationship between potato ( Solanum tuberosum) different genetic traits and its response to water stress, we analyzed the genetic diversity of test materials by the methods of SSR, studied the content variation of peroxidase (POD and CAT) activity and soluble protein of different potato varieties under water stresses by processing potato transplanting seedling for PEG-6000 simulated water stress and natural water stress method. The results showed that the genetic similarity coefficient (GS) at 0.700 level, 44 potato materials can be divided into five types, most breed clustered together, explaining the genetic basis of testing varieties is still relatively narrow. Through a GGE-biplot comprehensive analysis of soluble protein, POD and CAT variation, 44 selected materials were divided into 6 groups. Comparative analysis of genetic diversity analysis and physiological results found that there were no obvious consistency between them, namely the species differences in genetic traits can't react their drought resistance performance difference directly. But two stress modes with high consistency on studying the characteristics of varieties of drought resistance. This research provides the reference for further drought resistance research.
自1995年Veilleux[1]首次使用SSR标记研究马铃薯(Solanum tuberosum)以来, SSR标记因其多态性高, 可重复性好, 操作简单等优点而被广泛应用于马铃薯遗传关系分析研究[2, 3, 4], 品种鉴定[5], 重点种质资源的收集和评价[6]等方面.近年来, 中国学者在应用SSR对种质材料遗传多样性分析[7, 8, 9, 10], 作物抗旱性相关基因的SSR分子标记[11], 水分胁迫下抗旱相关性状的QTL分析[12]及对控制水分胁迫应答蛋白的相关基因的SSR标记[13]等方面也做了大量的研究.
干旱是影响植物正常生长发育的主要环境胁迫因素之一[14].植物在长期进化过程中, 演化出一系列形态学的和生理生化方面的适应性机制和策略, 能有效抵制胁迫逆境如调节保护酶系统[15, 16], 改变过氧化物酶(POD), 过氧化氢酶(CAT) 的活性等, 在逆境胁迫下动员酶和非酶防御系统来清除活性氧, 保护植物细胞免受氧化损害.自1979 年, Heyser和Nabors[17]首次以PEG作为诱导剂和筛选剂筛选出抗旱的烟草(Nicotiana tabacum)细胞系以来, 高分子量的聚乙二醇(PEG)(分子量≥ 6 000)常作为一种非穿透渗透剂被广泛用于植物研究领域[18, 19, 20, 21].然而, 关于不同马铃薯品种在PEG-6000溶液处理下进行模拟干旱胁迫与自然干旱水分胁迫处理方面的研究很少.同时, 众所周知, 作物在水分胁迫条件下的抗性因品种遗传特性的不同而异, 而就能否从遗传多样性的角度来解释不同种质间胁迫响应差异方面的研究还未见报道.
本研究通过SSR分子标记对44份马铃薯材料的遗传多样性进行分析, 并利用GGE-Biplot对44份马铃薯材料在水分逆境胁迫下的响应能力进行综合评价分析, 尝试从遗传多样性的角度解释不同种质间胁迫响应差异, 并探索两种水分胁迫方式在研究作物抗旱性能上是否具有一致性, 以期为马铃薯抗旱性材料的筛选和鉴定, 品种特性的改良等方面提供理论依据.
试验于2014年6-9月在甘肃农业大学作物遗传育种和干旱生境作物学重点实验室进行, 本研究选用42份从国际马铃薯研究中心(CIP)引进的马铃薯材料(表1)和两份本地品种, 即抗逆性较强的栽培种陇薯3号(L3)和对逆境胁迫较敏感的栽培种大西洋(DXY)脱毒试管苗为试验材料.所有品种均由甘肃农业大学马铃薯品种改良重点实验室提供.
| 表1 42份引进马铃薯种质材料编号及亲本材料 Table 1 Code of potato accessions and its parent materials |
1.2.1 马铃薯材料试管苗的培养 以同一时期转接的长势相对一致的脱毒试管苗为基础苗, 将其剪成至少带一片叶的小茎段, 插入装有固体培养基(MS)50 mL的三角瓶中, 每瓶扦插6~8个茎段.置于平均温度为(22± 2) ℃ , 光照为3 000 lx, 光周期为16 h· d-1的培养室进行培养.
1.2.2 基因组DNA的提取与检测及试管苗的移栽 1)剪取培养30 d左右的各供试材料试管苗新鲜茎叶, 用液氮研磨并参考 CTAB[22]法提取总基因组DNA.采用1%琼脂糖凝胶电泳检测DNA质量, 用紫外分光光度计法检测其质量和浓度.用ddH2O将各样品稀释到25 ng· μ L-1, 置于-20 ℃ 冰箱保存.2)将经过炼苗的试管苗洗去培养基, 剪去根部(保留一部分), 移栽入装有蛭石(基质)的72孔育苗盘中(皿数6× 12, 口径40 mm× 40 mm, 底部20 mm× 20 mm, 皿深45 mm), 种植深3~4 cm, 每个品种每个处理各种12株, 移栽在不同的穴盘上, 共36株.扦插后, 浇透水, 将育苗盘摆放在培养室, 盖上塑料薄膜保湿5~7 d.每隔1 d浇1次水(1周浇3次水), 每隔1周浇1次营养液(即不加蔗糖的液体MS培养基), 营养液pH值在5.8左右.移栽苗在育苗盘生长20 d后进行试验处理.PEG处理组用10% PEG(-0.120 MPa)浇灌(第1次10% PEG 10 mL· 穴-1, 其余几次均为10% PEG 5 mL· 穴-1); 自然胁迫处理组不浇水; 对照(CK)正常浇水, 水量和处理组PEG的量一致.处理6 d后, 最早发现2号材料PEG处理组的植株出现萎蔫症状, 拍照, 采样后分装并冷冻于-80 ℃ 冰箱备用.
1.2.3 SSR条带检测与相关生理指标的测定 参照已发表的24对SSR引物[5, 8, 23]并由上海生工生物工程技术服务有限公司合成(23对表2已列出), 进行SSR-PCR扩增, PCR产物用8.0%非变性聚丙烯酰胺凝胶电泳分离检测, 银染显色并统计多态性条带.
| 表2 23对SSR引物在44份马铃薯材料中的多态性 Table 2 Polymorphisms detected with 23 SSR primer pairs among 44 potato materials |
过氧化氢酶(CAT)的活性测定采用紫外吸收法[24]; 过氧化物酶(POD)活性测定采用愈创木酚法[24], 可溶性蛋白质的提取及含量测定采用考马斯亮蓝G-250法[24].
1.2.4 条带统计与数据分析 采用人工读胶法统计电泳谱带, 在同一位置上清晰的条带记为1, 无条带记为0, 扩增不出的记为-9, 建立0, 1数据库并保存到Excel中.利用 NTSYS-pc 2.10e软件[25], 通过UPGMA方法进行聚类分析.通过Popgene1.32软件[26]计算每个位点的等位变异数目, 有效等位基因数目[27], Shannon's信息指数[28]及等位基因频率; 计算多态性信息含量(Polymorphism Information Content):PIC=1-∑ (
用Microsoft Excel 2007对生理数据进行输入, 整理, 并计算出对应品种胁迫前后酶活性的变化量, 相对变化量=(胁迫后植株体内酶含量-处理后对照组中酶含量)/对照中酶含量× 100%; 通过SPSS Statistics 18.0 软件进行SPSS方差分析(Analysis of Variance ANOVA)(P≤ 0.05)和聚类分析, 多重比较采用最小显著差数法(LSDα )和新复极差法(Duncan法), 用来检测不同品种胁迫前后酶活性变化量差异.检测到显著差异P≤ 0.05后, 使用GGE-Biplot软件[23, 30]对两向数据进行主成分分析.
本研究用24对SSR引物对44份马铃薯供试材料进行PCR, 选出其中多态性较好的23对SSR引物(表2).结果显示, 23对SSR引物在44份供试材料中共检测到66个SSR标记, 平均每个等位位点的等位变异数为2.869 6, 变异范围为2~5; 平均等位变异数为2.463 1, 平均有效等位变异所占的比重为72.88%; 23对SSR引物的Shannon's信息指数的变化范围为0.248 9~1.334 8, 平均为0.776 2; 多态性信息含量 (PIC)变化范围为0.127 1~0.727 1, 平均为0.465 0, 表明供试材料的遗传多样性较高(表2).
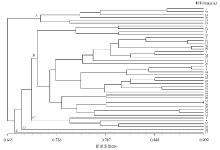
为了分析供试材料的遗传相似系数(GS), 并以更直观的方式揭示材料间的亲缘关系.本研究利用NTSYS-pc 2.10e软件分析了供试马铃薯材料的遗传相似系数(GS), 并根据UPGMA方法进行聚类分析.结果显示, 44份供试马铃薯材料的遗传相似系数变异范围为0.484 9~0.909 1.其中31和36号材料之间的遗传相似系数最大(GS=0.909 1), 表明这两份材料的遗传背景相似; 其次是材料8与9 和28与29(GS=0.893 9), 所以不建议用材料31与36, 8与9和28与29进行亲本杂交组合配置; 遗传相似系数最小的是材料4与14(GS=0.484 9), 说明材料4与14之间的亲缘关系较远, 遗传差异性较大.UPGMA方法聚类分析发现(图1), 在遗传相似系数(GS)为0.700水平上, 44份马铃薯材料可被聚为5类, 分别记为A, B, C, D和E, 每类分别包含有6, 32, 4, 1和1份马铃薯材料.B类中所包含的32份马铃薯材料, 占所有供试材料的72.7%.
为了分析两种处理下各不同变量之间的相关性, 判断分析两种水分胁迫方式之间是否有一定的一致性.采用SPSS R型聚类(变量聚类), 对PEG处理下可溶性蛋白相对于对照的变幅(PEG-P或PEG protein), PEG处理下POD相对于对照的变幅(PEG-POD), PEG处理下CAT相对于对照的变幅(PEG-CAT), 自然胁迫下可溶性蛋白相对于对照的变幅(ZR-P或ZR protein), 自然胁迫下POD相对于对照的变幅(ZR-POD), 自然胁迫下CAT相对于对照的变幅(ZR-CAT)共6个变量进行相关性分析(表3), 结果显示, ZR-POD与PEG-POD之间显著相关, 相关系数最大, 为0.965, ZR-CAT与PEG-CAT之间显著相关, 相关系数为0.933, ZR protein与PEG protein间显著相关, 相关系数为0.888, 均在P< 0.01水平上达到极显著.不同胁迫处理下, 同种酶酶活性变量间相关性较高, 说明不论是PEG模拟水分胁迫还是自然水分胁迫, 对马铃薯相关生理生化指标的影响具有较高的一致性.材料1因在前期试验中死亡, 故后续生理测定试验中只测定了43份材料.
| 表3 处理变量相似矩阵 Table 3 Proximity Matrix |
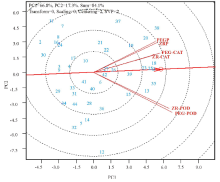
为了对供试马铃薯材料进行生理上群体划分并解释各处理变量之间的关系, 本研究利用GGE-Biplot对43个品种不同处理下不同酶活性变化量进行了分析(图2).图2中的多边形由连接同一方向上距双标图原点最远的品种的酶活性变化量位点构成, 其余的品种都被包括在多边形内部.由原点出发并且与多边形各边垂直的射线将整个双标图分为6个大小不同的区域, 并由此将不同品种分为6个组, 即a, b, c, d, e和f.
 | 图2 GGE-Biplot双标图分析不同马铃薯品种与不同胁迫处理方式及胁迫前后不同酶活性变化间的关系Fig.2 Polygon view of enzyme activity changes for different potato genotypes under different treatments |
处理变量可以被分为两个组:PEGP(PEG protein), ZRP(ZR protein), PEG-CAT及ZR-CAT为一组, PEG-POD和ZR-POD为一组, 而且第一主成分(PC1)与第二主成分(PC2)一起可以解释84.1%的变量, 说明双标图足以解释不同处理下不同酶活性变化量与不同品种间的差异.不论是在PEG处理下, 还是在自然水分胁迫下, 可溶性蛋白含量及CAT活性在品种38中变化量最大, 而POD在品种35中的变化量最大, 说明相比于其它品种, 35和38的抗氧化系统对干旱胁迫的响应更为灵敏.
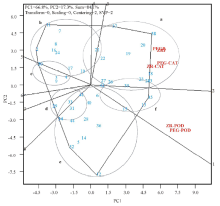
为了分析不同供试材料在胁迫前后酶活性变化量的大小及同一品种在不同酶活性测定下, 其变化量的稳定性, 本研究利用GGE-Biplot对43份供试马铃薯材料在水分胁迫诱导前后酶活性的变化量进行排序, 并对其变化量的稳定性进行分析.图中带箭头的直线是平均处理轴, 它同时经过双标图原点和平均处理值(红色圆圈), 其位置取决于各处理坐标的平均值[31], 箭头所指的方向是酶活性变化量在所有处理下的近似平均变化量, 箭头方向代表变化量越大.通过双标图原点并与平均处理轴垂直的双箭头直线代表各品种酶活性变化量的稳定性, 箭头所指的方向为变化不稳定, 并且越偏离平均处理轴, 说明变化量越不稳定.如图3所示, 品种23, 13, 20, 25, 43, 35, 18和38的变化量均高于平均值, 而且品种38的变化量最大.但是, 13, 20, 35, 38这4个品种的位点与平均处理轴间的距离较远, 所以它们的变化易受不同酶活性测定的影响, 稳定性较差.为进一步分析不同处理间及不同酶活性测定间的关系, 利用GGE-Biplot进行区别力与代表性的分析.如图4所示, 连接各处理变量的位点与双标图原点的直线称为处理向量.向量的不同长度反映的是不同处理变量对酶活性变化量的区别能力, 向量之间的夹角的余弦值近似代表两个处理变量之间的相关性系数[30].除PEG-POD与ZR-POD外, 各处理的向量长度比较接近, 说明同一酶活性变化量在不同处理变量下的变化趋势较接近.PEG-P与ZR-P, PEG-CAT与ZR-CAT, PEG-POD与ZR-POD之间的夹角均很小, 说明PEG胁迫处理和自然胁迫处理之间具有较高的相关性, 这与通过SPSS R型聚类对各处理变量间的相关性分析结果一致.而两种胁迫处理下POD测定与可溶性蛋白, CAT测定间的夹角较大, 虽然小于90° , 但仍能说明, 即使在相同的胁迫处理下POD活性变化量与可溶性蛋白, CAT活性变化量之间的变化差异较为明显, 尤其与可溶性蛋白含量的变化更为明显.
 | 图3 利用GGE-Biplot分析43份马铃薯材料在两种胁迫处理下酶活性变化量的排序Fig.3 Ranking of enzyme activity changes between treatments and potato genotypes by GGE-Biplot |
通过对种质材料遗传相似系数的研究分析发现, 供试材料遗传背景的相似性与其遗传相似系数大小之间具有一定的相关性.如本研究中材料28与29具有相同的父本和母本, 材料33与34则只具有相同的父本, 育成品种亲缘关系亦比较近, 这与材料28与29(GS=0.893 9)和33与34(GS=0.878 8)较高的遗传相似系数是一致的, 这也与刘建霞等[7, 8, 9]的相关研究中遗传背景相似的品种遗传差异较小的结论是一致的.然而, 31和36号材料的亲本虽然完全不同, 但二者之间的遗传相似系数最大(GS=0.909 1), 仍表明这两份材料的亲缘关系是较近的, 这可能是由于材料本身遗传特性的差异或发生遗传变异引起的, 也有可能是由于SSR分子标记试验所用的引物较少, 未能充分表现材料本身的遗传特异性等原因引起的.
马铃薯根系较浅, 对水分亏缺非常敏感[32].水分亏缺会对植物的生长状况, 形态结构与生理生化产生显著影响[33, 34].本研究发现, 受到水分胁迫后, 不同马铃薯植株体内POD, CAT活性及可溶性蛋白含量较对照均有所上升, 这与大量研究报道[35, 36, 37]一致.且几种酶活性变化在两种不同的胁迫处理间具有较高的相关性, 这与抗艳红等[34], 张立军等[38]的PEG模拟干旱试验测得的生理指标与室外旱池的实际抗旱指标有较好的一致关系的结论相符合.
综合比较SSR分子标记聚类分析与生理分析结果, 发现两种聚类分析结果间并不具有较高一致性.例如SSR聚类分析B类中的材料31和36间因具有较高的遗传相似系数(GS=0.909 1)而被聚在一起, 与此同时, 二者在受到水分胁迫后在生理生化反应也具有一定的一致性, 而被聚为同一组(e)中.然而, 对于大部分品种来说, 遗传亲缘关系的远近与其对生理胁迫的响应间并不具有高度的一致性.如材料28, 29具有相同的父本[392 820.1=(C93.154)]和母本(CHIEFTAIN), 遗传背景相似而聚在一起, 然而, 二者在对水分胁迫的响应并不一致, 分别属于不同的组, 即d和e.同样, 材料8, 9间因具有较高的遗传相似系数(GS=0.893 9)而被聚在一起, 但二者在受到水分胁迫后其生理生化反应并不具有较高一致性, 二者分别属于不同的组, 即b和c.综合多个品种遗特性及对生理生化响应的差异, 发现二者之间并不具有简单的相关性.其主要原因可能为:1)材料多样性分析的出发点不一样.SSR分子标记通过分析, 且广泛分布在真核生物基因组上的, 由于其重复次数不同或重复程度不完全而形成每个座位的多态性, 对物种种质资源进行遗传多样性分析[39].然而, GGE-Biplot聚类分析是通过检测植物受到水分逆境胁迫后, 其体内抗氧化物酶活性的变化情况, 对供试材料的水分逆境胁迫响应快慢进行的分析.2)两种试验方法采用了不同的统计分析软件, 数据算法不一样, 如SSR分子标记使用NTSYS-pc2.10e, 采用UPGMA法构建聚类图, 而水分胁迫后, 酶活性变化的分析采用SPSS R型聚类, 因此也使得聚类结果有差异.3)SSR分子标记试验所用的引物较少, 因此扩增获得的多态性条带数目也有限, 未能充分表现材料本身的遗传特异性.另一方面, 植物对水分胁迫逆境的响应机制是由多种因素共同参与的复杂过程[7, 40], 单纯的对水分胁迫逆境下对抗氧化物酶活性的测定并不能充分表现品种的生理特性.
本研究通过SSR分子标记技术将44份马铃薯材料在遗传相似系数(GS)为0.700水平上被聚为5类, 且大部分品种被聚在一个类群, 说明供试品种遗传基础还是相对狭窄.遗传相似系数较大的品种往往被聚在一起, 说明它们的亲缘关系较近.通过水分胁迫试验发现, 马铃薯移栽苗受到PEG-6000浇灌和自然不浇水两种胁迫处理后其体内的POD, CAT及可溶性蛋白含量相对于对照均上升, 且同一种酶在两种胁迫处理下的变化量具有较高的相关性, 说明两种水分胁迫方式在鉴定马铃薯抗旱特性上具有较高的一致性.综合分析3种酶在两种胁迫处理下, 不同品种中的变化量, 将43份材料聚为大小不一的6组.综合比较两种聚类结果发现, 二者并不具有一致的相关性, 说明不能从遗传多样性的角度很好地解释不同种质间对胁迫响应差异, 其原因还有待于进一步研究.
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|