第一作者:李菁(1991-),女,甘肃兰州人,在读硕士生,主要从事牧草栽培生理生态及牧草繁育的研究。E-mail:15101259525@163.com
以两个不同生态型的柳枝稷( Panicum virgatum)Alamo(低地型)和Cave-in-Rock(高地型)为试验材料,研究在0、50、100和150 mmol·L-1 NaCl浓度下,分别添加0、 0.5、 1.0和2.0 mmol·L-1的外源硅(Na2SiO3·9H2O)对其叶片光合色素含量及光合气体交换参数的影响。结果表明,Alamo叶片的叶绿素a、叶绿素b以及叶绿素a+b的含量均随着NaCl浓度的升高呈现降低趋势,但是Cave-in-Rock的变化趋势则相反。在无外源Si处理下,Alamo叶片净光合速率(Pn)和气孔导度(Gs)在50 mmol·L-1NaCl浓度下升高,100和150 mmol·L-1下降低;Cave-in-Rock的Pn、Gs和胞间CO2浓度(Ci)随着NaCl浓度的增加逐渐降低。盐胁迫下,适当浓度外源硅(Si)的添加对Alamo和Cave-in-Rock叶绿素a、叶绿素a+b和叶绿素b、类胡萝卜素含量的提高具有积极的作用。外源Si的添加同样提高了盐胁迫下Pn、Gs和Ci等参数。本研究中,1~2 mmol·L-1 Na2SiO3·9H2O对盐胁迫下柳枝稷叶片光合色素及光合气体交换的促进作用较明显。
The effects of silicon on chlorophyll content and gas exchange characteristics of two different ecotype varieties switchgrass ( Panicum virgatum) including “Alamo”(lowland) and “Cave-in-Rock”(upland) under salt stress were investigated. The concentrations of NaCl and Si NaSiO3·9H2O were 0, 50, 100, 150 mmol·L-1 and 0, 0.5, 1, 2 mmol·L-1, respectively. The results showed that the chlorophyll contents of “Alamo” decreased significantly ( P<0.05) under salt stress, but that of “Cave-in-Rock” slightly increased. The net photosynthetic rate (Pn) and stomatal conductance (Gs) of “Alamo” increased at 50 mmol·L-1 NaCl level, then decreased at 100 and 150 mmol·L-1 levels of NaCl concentrations. Pn, Gs and intercellular CO2 concentration (Ci) of “Cave-in-Rock” decreased significantly ( P<0.05) with increasing NaCl levels. Optimal concentration of exogenous silicon addition had alleviated the reduction of chlorophyll and improved gas exchange ability of “Alamo” and “Cave-in-Rock” under salt stress. In our study, 1-2 mmol·L-1 was the optimal concentration of silicon (Si).
柳枝稷(Panicum virgatum)是一种起源于北美大草原的暖季型C4植物。依据其栖息地、染色体数、分子特性等因素的不同, 将其划分为低地型和高地型生态类型, 前者是四倍体, 高1.5~2 m, 适宜生长在潮湿的环境中, 后者有六倍体或十二倍体, 高3~4 m, 一般生长在较为干燥的地方[1]。柳枝稷是具有一定营养价值的饲料, 可直接生产干草也可用来放牧[2]。柳枝稷的适应性较好, 在一些边缘土地上能够改良土壤和发展生长。此外, 柳枝稷还被认为是生产纤维素乙醇的能源作物[3]。20世纪初, 柳枝稷被成功引种到我国黄土丘陵地区的陕北安塞种植, 表现出抗旱、耐寒和产草量较高等特点[4]。
土壤盐渍化是植物生长面临的最主要的非生物胁迫之一, 全世界大约20%的耕地和50%灌溉土地正遭遇不同程度盐渍化的影响[5]。因此, 土壤盐渍化是农业生产面临的巨大挑战之一。盐胁迫影响了植物一系列重要的生物化学反应, 例如, 盐胁迫导致植物水分亏缺[6], 细胞膜质过氧化[7], 叶绿素浓度和光合气体交换速率降低[8, 9], 矿质营养元素的吸收受阻等, 最终导致植物生物量减少或死亡[10]。
硅(Si)是地壳中含量仅次于氧(O)的第二大元素, 以不溶性硅酸盐的形式存在于土壤中[11]。植物能以硅酸钠(Na2SiO3)、硅酸钙(CaSiO3)和硅酸(H4SiO4)等形式吸收硅[12], 是植物生长的必需元素[13]。一定量的硅对植物生长发育是有益的, 如促进植株生长[14], 提高植物抵御逆境的能力等[15]。Si能够缓解逆境胁迫对植物的伤害是植物抗逆生理研究中的热点。例如, 硅能够提高逆境胁迫下金丝小枣(Zizyphus jujube)[16]、玉米(Zea mays)[17]等植物叶片的叶绿素含量并改善光合气体交换的能力。柳枝稷生长在边缘土地上, 常被用于改良盐渍化土地, 但Si对盐胁迫下C4植物柳枝稷光合生理特征影响的研究仍鲜有报道, 本研究以低地型和高地型柳枝稷为试验材料, 进行不同梯度的盐胁迫和外源Si添加, 旨在阐明盐胁迫下不同生态型柳枝稷的叶绿素及光合气体交换的特征, 以及硅调控盐胁迫下柳枝稷叶绿素及光合气体交换参数的规律。
供试品种低地型(Alamo)和高地型(Cave-in-Rock)柳枝稷, 由美国南达科他州立大学提供。
1.2.1 种子萌发及幼苗培养 挑选饱满均一的柳枝稷种子在95%的酒精中消毒5 min, 蒸馏水冲洗数次后放在培养皿中, 在30 ℃的培养箱中发芽7 d。选取生长均一且完整的幼苗移栽到由蛭石和珍珠岩混合的育苗盘内(体积比为3:1)。移栽后的育苗盘置于西北农林科技大学动物科技学院温室[昼夜温度为(30± 5) ℃/(20± 5) ℃]内进行生长。隔天分别定量浇灌1 L水以及500 mL 1/2 Hoagland营养液[18], 培养30 d后进行处理。
1.2.2 试验处理 试验用分析纯氯化钠(NaCl)设4个盐处理浓度, 0、50、100和150 mmol· L-1(Na0、Na50、Na100、Na150); Si处理用分析纯硅酸钠(Na2SiO3· 9H2O)设0.0、0.5、1.0和2.0 mmol· L-1(Si0、Si0.5、Si1.0、Si2.0)。每处理5个重复。处理期间, 除了补充水及Hoagland营养液外, 每周每个处理苗盘均分别浇灌1 L的 NaCl溶液和1 L的Na2SiO3溶液。盐浓度的添加量准确扣除了因加入Na2SiO3而引入的钠离子。处理45 d后进行叶绿素含量和光合气体交换参数的测定。
1.3.1 叶片光合色素含量的测定 随机称取完整且健康的植物叶片0.1 g, 加少量石英砂、碳酸钙及80%丙酮在研钵中研磨至匀浆发白, 过滤到25 mL棕色容量瓶中, 并用少量丙酮数次冲洗研钵、杵、残渣及滤纸, 将叶绿体色素全部转移至容量瓶中, 最后定容至25 mL, 摇匀。利用紫外分光光度计(日本, 岛津uv3100)在663、645和470 nm下测定吸光度, 并计算出叶绿素a、叶绿素b和类胡萝卜素的含量[19]。
1.3.2 光合气体参数的测定 选取柳枝稷中上部健康无损伤的叶片, 在09:00用LI 6400便携式光合仪(LI-COR, Lincoln, Nebraska, USA)测定各处理叶片的光合气体交换参数, 净光合速率(Pn)、气孔导度(Gs)和胞间CO2浓度(Ci), 气孔限制值(Ls)计算公式:
气孔限制值(Ls)=1-Ci/Ca。Ca为样品室内CO2浓度。
每个处理测定5株。测定时设定光照强度在800 μ mol· (m2· s)-1, 参比室CO2浓度为(400± 10) μ mol· mol-1, 相对湿度(RH)为60%~70%。
使用Excel 2003软件对数据进行处理和图表绘制, 使用SPSS 17.0软件进行统计分析, 对同一品种不同处理下的生理指标进行单因素方差分析, 并用Duncan法进行多重比较; 对不同品种相同处理下进行F检验。
在Si0处理下, Alamo叶片的叶绿素a、叶绿素b、类胡萝卜素和叶绿素a+b含量均随着NaCl浓度的升高而降低, 且Na100和Na150均与Na0间差异显著(P< 0.05)。当盐浓度达到150 mmol· L-1时, 上述光合色素各组分降到最低, 相比Na0分别降低了56.58%、57.30%、70.15%和64.94%(图1)。
外源Si对Alamo叶片光合色素各组分也有影响。在Na0水平下, Si0.5与Si0相比, 其叶绿素b的含量增加, 但两者差异并不显著(P> 0.05), 其余各组分与Si0相比均有不同程度的降低; 而在Na100处理下, Si2.0处理的叶绿素a及叶绿素a+b含量与Si0相比分别增加了24.82%和17.44%(P< 0.05); 在Na150处理下, Si0.5、Si1.0和Si2.0处理的叶绿素a、叶绿素b、叶绿素a+b和类胡萝卜素的含量均显著高于Si0(P< 0.05)。此外, 与Si0 Na0相比, 各盐处理下Alamo叶片中叶绿素a的下降程度低于叶绿素b, 所以叶绿素a/b均有所增加。
Cave-in-Rock 叶片光合色素各组分亦受NaCl和Si的影响(图1)。在Si0处理下, 叶绿素a、叶绿素b和叶绿素a+b的含量均随NaCl浓度的增加而呈现上升趋势, 且Na150与Na0差异显著(P< 0.05), 这与盐胁迫下Alamo叶片光合色素含量的变化趋势相反(图2)。在Si0处理下Na0和Na50处理时, Alamo和Cave-in-Rock之间的叶片光合色素各组分含量存在显著(P< 0.05)或极显著(P< 0.01)差异(图1)。
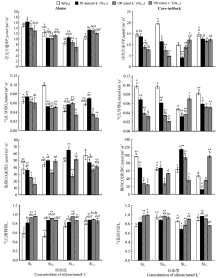 | 图2 外源Si添加对NaCl胁迫下Alamo和Cave-in-Rock光合气体交换参数的影响Fig.2 Effect of Si addition on photosynthetic gas exchange parameters of Alamo and Cave-in-Rock under NaCl stress |
外源Si的添加同样对Cave-in-Rock叶绿素各组分也有影响。在Na0时, Si1.0和Si2.0均能提高其叶片光合色素的含量, 而且在 Si0.5、Si1.0时Cave-in-Rock和Alamo之间的叶片光合色素各组分含量存在显著(P< 0.05)或极显著差异(P< 0.01)(图1)。在Na50时, 与Si0 Na50相比, 外源硅的添加, 能不同程度地提高Cave-in-Rock叶片光合色素各组分含量; 在Na100时, Si1.0处理下叶片类胡萝卜素和叶绿素a+b含量比Si0处理分别增加了76.92%和33.73%(P< 0.05); 在Na150时, Si1和Si2处理下, Cave-in-Rock叶片类胡萝卜素含量相比Si0分别增加了36.36%和22.73%(P< 0.05), 而且Cave-in-Rock与Alamo间叶片叶片光合色素各组分含量差异极显著(P< 0.01)(图1)。此外, 在Na50盐浓度下, Si1.0和Si2.0处理显著提高了叶绿素b的含量(P< 0.05)。
在无外源Si处理下, 随着NaCl浓度的升高, Alamo叶片Pn和Gs均呈现出先升高后降低的变化趋势(图2)。其中, Na50与Na0相比, Pn两者无显著差异(P> 0.05), Gs Na50显著高于Na0(P< 0.05); Na100和Na150 Pn和Gs与Na0相比均无显著差异(P> 0.05)。Ci随NaCl浓度的升高而降低, 与Na0相比, Na50降低了4.31%, Na100和Na150分别显著降低了32.11%和59.53%(P< 0.05); 而Ls随着NaCl浓度的增加而增加, 与Na0相比, Na50、Na100和Na150分别显著增加了39.81%、59.89%和64.42%(P< 0.05)。
外源Si的添加同样影响了Alamo的光合气体交换参数。在各个盐胁迫处理下, Pn随Si浓度的增加大致呈现先降低后升高的趋势(图2), Si2提高了各盐浓度下的Pn; 在Si1.0处理下, 相比Na0和Na150, Si1.0提高了Na50和Na100的Gs, 而在Si2.0处理下, Si2.0只提高了Na50的Gs, 但与Si0Na50和Si0, Na100相比, 差异并不显著(P> 0.05)。而在Na50和Na150处理下, Si1处理显著提高了Ci(P< 0.05)。添加外源Si对Ls无规律影响。
盐胁迫对Cave-in-Rock的气体交换参数的影响表现各异(图2)。盐胁迫下, Pn、Gs和Ci随着盐浓度的增加逐渐减低, 且Na100和Na150显著低于Na0和Na50(P< 0.05), 但Ls逐渐升高且Na100和Na150显著高于Na0和Na50。以Pn为例, 与Na0相比S50、S100和S150、分别降低了12.84%、32.46%和35.13%。外源Si的添加同样调节了盐胁迫下Cave-in-Rock的气体交换参数。尽管外源Si的添加并没有提高Na50处理下的Pn和Gs, 但Si1.0显著提高了Na150处理下叶片的Pn和Gs(图2); Si2.0显著提高了Na100和Na150处理下叶片的Pn和Gs(P< 0.05)。总体看, Si1.0对Na50和Na100下Cave-in-Rock叶片Ci的提高效果显著, 而Si2.0对Na150下Ci的提高效果显著; 同时, Si2.0也显著降低Na100和Na150处理下的Ls(图2)。
在Na50处理下, Alamo和Cave-in-Rock间Gs和Ci差异极显著(P< 0.01); 在Na100处理下, Alamo和Cave-in-Rock间Pn、Gs、Ci和Ls分别存在显著(P< 0.05)或极显著(P< 0.01)的差异; 在Na150处理下, Ci和Ls具有显著差异(P< 0.05); 在Na0处理下, 0.5、1.0和2.0 mmol· L-1 Si的添加使得Alamo和Cave-in-Rock的气体交换参数分别存在显著(P< 0.05)或极显著(P< 0.01)差异; 在Na50Si1.0处理下, 两个生态型柳枝稷的Pn、Gs、Ci和Ls差异显著(P< 0.05)或极显著(P< 0.01)。
光合气体交换能力直接影响了植物的生长及产量, 而叶片光合色素含量的高低是影响光合能力的重要因素之一。本研究中, 无外源Si处理下Alamo叶绿素a、叶绿素b、类胡萝卜素的含量随着盐浓度的增加均降低, 而叶绿素a/b逐渐升高。前者是由于盐胁迫破坏了叶绿体的结构, 降低了叶绿素含量[8, 20], 而后者可能是盐胁迫下叶绿素酶活性增强, 主要降解叶绿素b导致的[20], 这与青稞(Hordeum vulgate)[21]的研究结果一致。本研究中Cave-in-Rock叶绿素对盐胁迫的响应规律与Alamo相反, 盐浓度不但没有抑制反而增加了其叶绿素含量, 这与杜菲等[20]的研究结果相一致, 而这可能是由于Cave-in-Rock为八倍体植物, 而Alamo为四倍体植物[22], 二者倍性的不同, 导致较高浓度盐胁迫(< 200 mmol· L-1)下, Cave-in-Rock叶绿素含量呈上升趋势[20]。但与此同时, Cave-in-Rock的Pn随着盐浓度的升高而明显降低, 而Alamo的Pn则在50 mmol· L-1时有小幅升高, 然后显著降低(P< 0.05)。这说明, 叶绿素含量的高低与其Pn和抗盐性强弱之间并无直接的关系[23]。大量研究表明, 适量外源Si的添加能提高盐胁下迫植物叶绿素的含量[16, 17], 本研究对Alamo和Cave-in-Rock的研究也证实了上述结论。外源Si的添加维持了逆境胁迫下植物叶片较高的水势, 缓解了盐胁迫对叶绿体超微结构的破坏作用[24], 抑制了叶绿素酶对叶绿素的降解[17, 19], 从而提高了其盐胁迫下叶绿素的含量。但逆境胁迫下外源Si对植物叶绿素合成的促进机制尚需进一步补充分子证据来揭示。
盐胁迫严重降低了植物的Pn[8]。本研究中, 高浓度盐胁迫下Alamo和Cave-in-Rock的Pn均明显降低, 只是不同生态型的柳枝稷抗盐能力有差异, 导致其Pn下降幅度不同。但是, 在Na50处理下, Cave-in-Rock的Pn低于Na0, Alamo却高于Na0, 而Alamo耐盐性较Cave-in-Rock相对较低, 这可能是由于Alamo和Cave-in-Rock倍性、分蘖能力之间存在差异, 进而导致Cave-in-Rock耐盐性虽高于Alamo, 但其在Na50时的Pn却呈现轻微下降的趋势[20, 22]。此外, 关于柳枝稷叶片细胞形态学结构的研究[22]表明, 不同生态型柳枝稷的气孔面积大小、硅细胞密度大小、液泡长度以及叶脉厚度间存在差异, 这可能也是导致Alamo和Cave-in-Rock的Pn在Na50时呈现出不同变化趋势的原因之一。逆境对植物光合碳同化的限制主要由气孔因素和非气孔因素所导致[25]。 对Alamo的研究表明, 重度盐胁迫下, 柳枝稷光合作用的减弱主要是由气孔因素所引起的[26]。本研究中, 在高浓度盐胁迫下两个生态型柳枝稷的Pn、Gs、Ci和Tr均显著降低, 也进一步说明气孔因素是限制盐胁迫下柳枝稷Pn下降的主要原因。但是, 盐胁迫下Pn的降低是由气孔限制还是非气孔限制导致的是一个复杂的问题, 受植物生长阶段等多个因素影响。本研究中, 一定量外源Si的添加缓解了盐胁迫对植物光合作用的影响, 提高了两个生态型柳枝稷的光合气体交换参数。一方面外源Si的添加增加了逆境胁迫下植物叶表皮的栅栏组织和气孔密度, 提高了1, 5-二磷酸核酮糖(RuBP)羧化酶的活性[27], 从而直接促进了光合气体交换的进行; 另一方面, 外源Si的添加增加了逆境胁迫下植物根系的分支和对水分的吸收能力, 改善了叶片的水分状况[24], 提高了植物抗氧化酶和非酶抗氧化剂等的活性[28], 增强了渗透调节能力, 促进了类黄酮和其它酚类物质的积累[29], 从而有效清除和阻止活性氧对植物的损伤[28], 降低了叶肉细胞质膜的渗透性[30], 改善了光合细胞的内环境。此外, 外源Si的添加还通过增加逆境胁迫下植物可溶性蛋白质的含量和磷的含量[31], 改变植物组织的C:N:P, 降低对Na+的吸收, 通过降低Na+/K+等方式改善了植物在逆境胁迫下的营养状况[32]。但是, 外源Si的添加对植物的促进作用并不呈正比, 适量外源Si的添加能够促进根系和地上部分的生长[33], 但高浓度的Si会抑制植物生长[15]。本研究, 提高盐胁迫下叶绿素积累和光合气体交换的最佳外源Si的浓度是不一样, 这可能与物种的选择和试验处理手段等的差异有关[17]。
总之, 盐胁迫下, C4能源植物柳枝稷叶绿体结构被破坏, 光合气体交换参数降低, 由于两个生态型柳枝稷抗盐能力存在差异, 故其对盐胁迫的响应程度有所不同。外源Si的添加能够缓解盐胁迫的伤害, 改善叶绿素的构成, 提高光合气体交换的能力。由于植物种的不同和试验处理手段的差异, 最佳的外源Si添加浓度在各研究中是有差异的。本研究中, 1.0~2.0 mmol· L-1 Si对盐胁迫下柳枝稷叶绿素及光合气体交换的积极作用较明显。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|



