第一作者:鲍根生(1980-),男,青海乐都人,助理研究员,在读博士生,主要从事高寒草地植物保护学研究。E-mail:baogensheng2008@hotmail.com
青海高原的高寒特性决定其生境内禾草植物的多样性和特异性,然而有关青海高原地区禾草内生真菌的研究报道较少,本研究对青海高原地区48个样点内禾草植物内生真菌带菌率和内生真菌分离进行了研究。结果表明,14种禾本科植物内生真菌平均感染率低于50%,而12种植物内生真菌平均感染率大于50%。其中,缘毛鹅观草( Roegneria pendulina)、紫花针茅( Stipa purpurea)、醉马草( Achnatherum inebrians)、中华羊茅( Festuca sinensis)、硬质早熟禾( Poa sphondylodes)、微药羊茅( F. nitidula)、毛稃羊茅( F. kirilowii)和紫羊茅( F. rubra)的平均带菌率均超过80%。同时,同属禾草植物内生真菌带菌率存在差异。禾草内生真菌分离率较低,其中紫花针茅、麦宾草( Elymus tangutorum)、光稃早熟禾( P. psiolepis)和异针茅( S. aliena)内生真菌在菌落和分生孢子形态上存在差异。可见,青海高原禾草内生真菌带菌率较高,同时不同禾草内生真菌可能存在多样性。
The characteristics of high altitude and low temperature determined the diversity and heterogeneity of grass in Qinghai Plateau, however, there were fewer studies about grass endophytes in Qinghai-Tibet Plateau. The endophytic infection of native grasses collected from 48 locations in Qinghai Plateau were examined, meanwhile, endophyte were also isolated from infected grasses species. The results demonstrated that the average incidence of endophyte infection in 14 tested grass species were above 50%, however, that in 12 tested grasses were below 50%. The average incidence of endophyte infection in several grasses, such as Roeneria pendulina, Stipa purpurea, Achnatherum inebrians, Festuca sinensis, Poa sphondylodes, F. nitidula, F. kirilovii and F. rubra, were above 80%. Meanwhile, incidence of endophyte infection varied in same genus. The isolation frequency of endophyte was relative lower, the morphology of colonial and conidial varied among S. purpurea, Elymus tangutorum, P. psilolepis and S. aliena. It was concluded that the endophyte infection in native grass were higher in Qinghai Plateau and the endophyte might diversified among grass’s species.
青海高原地处青藏高原东北部, 位于31° 39'-39° 19' N, 89° 35'-103° 04' E, 平均海拔4 000 m以上[1]。涵盖亚热带常绿阔叶林、温带草原、亚非荒漠和高寒草甸等多种植被类群, 在这种特殊的环境中禾本科植物分布广泛, 以禾本科植物为建群种或伴生种构建了这一地区具有高寒特征的高寒草原和高寒草甸植物群落[2, 3, 4]。据相关资料记载, 青海高原有禾本科植物55属246种31个亚种和变种, 其中青海特有种10种2亚种[5, 6]。
禾草内生真菌(Epicholё sp.)宿主种类丰富, 主要分布于温带和寒带地区, 许多冷季型禾草与其共生的内生真菌建立了密切的互惠共生关系[7, 8, 9]; 在一定程度上, 内生真菌和宿主禾草之间存在着较为严格的宿主特异性[10, 11]。全世界范围内至少有80个属290多种禾本科植物感染内生真菌, 其中研究主要集中在多年生黑麦草(Lolium perenne)和高羊茅(Festuca elata)[12, 13, 14, 15, 16, 17]。Wä li等[16]研究表明, 细羊茅(F. arundinacea)带菌率低于20%; Rolston等[18]对新西兰禾草带菌率进行检测, 发现除羊茅属(Festuca)植物外其他禾草带菌率较低; Kirkby等[19]发现, 澳大利亚地区硬直黑麦草(L. rigidum)内生真菌带菌率随生境而变化, 带菌率介于4%~98%;
虽然, 上述研究也涉及部分青海高原地区禾草资源带菌率的检测, 然而青海高原地处北半球寒温带, 依据禾草内生真菌共生体主要分布在寒带和温带, 而赤道和极地尚未发现禾草内生真菌共生体分布的特点[7], 可以推测青海高原禾草资源感染内生真菌潜力较高; 同时当地禾草资源丰富且部分的禾草品种为青藏高原所特有, 这就表明青海高原禾草内生真菌资源可能存在较大的多样性和丰富性。然而, 迄今为止, 针对青海高原天然草地禾草内生真菌资源尚未展开较为系统的调查和研究。因此, 本研究主要对青海高原禾草内生真菌资源进行调查, 探寻青海高原地区禾草内生真菌的多样性, 以期为今后高寒地区禾草内生真菌资源深入研究提供基础资料。
2007、2009和2012年, 在青海高原地区天然草地选取48个样品采集点, 于牧草成熟季节(9月份)在每个样点分别以单株或单丛禾草为单位, 采集样点内禾草植物以供后续的带菌率检测。每个样点出现的禾草被认为该样地的禾草样品, 同时齐地面收获单株(丛)禾草并按采集点、禾草种名、采集时间和重复数进行编号记录。其中, 每个单株(丛)间间隔5~10 m, 共采集20单株(丛)。并对各个采集样点进行编号, 记录采集时间、地理位置、海拔和草地群落类型等信息(表1)。
| 表1 青海高原禾草内生真菌检测样品采集点信息 Table 1 The details of collection sites investigated for detection of endophytes among grasses in Qinghai Plateau |
禾草内生真菌检测采用种子苯胺蓝染色检测的方法, 具体方法为:在室温条件下(15~22 ℃)将种子置于5%氢氧化钠溶液过夜, 第2天用蒸馏水冲洗种子数次以去除种子表面的氢氧化钠, 然后将种子置于有苯胺蓝溶液(配方为0.325 g苯胺蓝溶于100 mL的蒸馏水, 并添加50 mL乳酸)的培养皿中静置2 h, 镜检前将种子外稃去除。将种子放置到载玻片上, 用盖玻片轻按使种子糊粉层和种皮分离, 在40倍目镜下观察内生真菌菌丝。如果种皮或糊粉层中出现大量的深蓝色的菌丝, 就认为该种禾草感染内生真菌, 每种禾草种子检测量为20粒[17, 23]。挑选单株(丛)带菌禾草的种子20粒用70%酒精消毒1 min, 无菌水冲洗两次, 然后用1%次氯酸钠消毒3 min, 用无菌水冲洗3次, 然后用消毒的滤纸吸干种子表面的无菌水。将消毒后的种子均匀地摆放到装有PDA培养基的培养皿中, 在25 ℃黑暗培养条件下培养3~4周, 期间每周检查培养物的生长情况, 把出现污染的培养皿及时清除。当内生真菌从种子表面出现后, 挑取少许菌落进行培养。待内生真菌产孢后, 挑取单个孢子进行纯培养, 根据上述培养条件进行4周生长速度测定, 并在第4周生长速度测定后选取50个孢子测定孢子形态、大小及分生孢子梗的长度[23, 28, 29, 30]。
样点内禾草内生真菌感染率按某种禾草带菌种子占该禾草供试种子百分比计算, 其中不同样点同一禾草内生真菌感染率是所用样点带菌率的平均值。
对青海高原48个样点禾草植物内生真菌带菌率的检测结果表明, 披碱草属(Elymus)、鹅观草属(Roeneria)、芨芨草属(Achnatherum)、艹洽草属(Koeleria)、冰草属(Agropyron)、赖草属(Leymus)、早熟禾属(Poa)、针茅属(Stipa)、羊茅属(Festuca)、拂子茅属(Calamagrostis)、野青茅属(Deyeuxia)和狗尾草属(Setaria)植物均感染内生真菌(表2)。其中, 披碱草属(3种)、针茅属(4种)、早熟禾属(5种)和羊茅属(5种)感染内生真菌概率较高。14种禾本科植物内生真菌平均感染率低于50%, 而12种植物内生真菌平均感染率大于50%。其中, 缘毛鹅观草(R. pendulina)、紫花针茅(S. purpurea)、醉马草(A. inebrians)、中华羊茅(F. sinensis)、硬质早熟禾(P. sphondylodes)、微药羊茅(F. nitidula)、毛稃羊茅(F. kirilovii)和紫羊茅(F. rubra)的平均带菌率均超过80%(表2)。其中, 10个样点紫花针茅带菌率高达100%。相反, 赖草(L. secalinus)、冷地早熟禾(P. crymophila)、长芒草(S. bungeana)、拂子茅(C. epigeios)、青藏野青茅(D. holciformis)、狗尾草(S. viridis)、光叶糙毛草(R. leiophylla)、羊茅(Festuca sp.)内生真菌感染率均低于30%。同属的禾草植物内生真菌带菌率也存在差异, 例如:早熟禾属的硬质早熟禾、光稃早熟禾(P. psilolepis)和西藏早熟禾(P. tibetica)带菌率高于50%, 而冷地早熟禾带菌率只有13%。
| 表2 青海高原禾草植物内生真菌带菌率检测结果 Tables 2 Grass species from Qinghai Plateau that were examined at all sites |
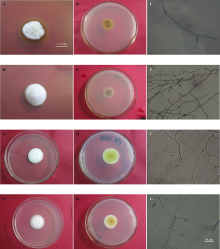
26种感染内生真菌的禾草植物中, 只有紫花针茅、麦宾草、光稃早熟禾和异针茅4个物种中成功分离得到内生真菌(表3)。其中, 光稃早熟禾菌落生长速度最快(10.8 mm· 周-1), 而麦宾草菌落生长速度最慢(3.8 mm· 周-1)。紫花针茅菌落正面边缘形成明显的棕色晕圈(图1A), 而其他内生真菌菌落边缘未发现晕圈。同时, 分离的内生真菌菌落反面质地颜色也存在差异, 例如:麦宾草和紫花针茅菌落反面颜色较暗(图1 B、E), 主要以褐色和棕色为主; 而异针茅和光稃早熟禾菌落反面颜色较浅, 以黄色为主(图1 H、K)。麦宾草分生孢子长度明显低于异针茅和紫花针茅, 与光稃早熟禾分生孢子长度相近。异针茅分生孢子梗长度明显长于其他3种, 光稃早熟禾和麦宾草分生孢子梗长度相近。而紫花针茅分生孢子梗基部宽度明显小于其他3种禾草内生真菌的分生孢子梗基宽。可见, 分离的内生真菌具备生长速度较慢、菌落正面白色、分生孢子着生在分生孢子梗顶端等特性, 符合Epichloë 属内生真菌菌落的基本特征, 确定分离所得4种内生真菌为Epichloë 属内生真菌。
| 表3 青海高原部分禾草内生真菌菌落生长速度及分生孢子生长情况 Table 3 Colonial growth and length of conidia of endophyte isolates obtained from four grass species of collection site in Qinghai Plateau |
青海高原地处青藏高原东北部, 由于海拔高、昼夜温差大和植物生长期较短等特征, 导致该地域禾草植物的生长和分布出现特异性[6, 31, 32]; 本研究首次较为系统地对青海高原地区禾草植物感染内生真菌情况开展调查, 结果表明, 青海高原禾草感染内生真菌率较高, 同时各物种间也存在差异, 其中醉马草和紫花针茅带菌率在各样点均较高(表2)。根据协同进化地理镶嵌假说, 自然选择对不同物种群落的作用效应存在差异。基因流、基因漂移、基因缺失或出现等因素共同作用, 形成了同一物种的不同种群在地球板块间呈现镶嵌分布的现象[33]。内生真菌与其宿主禾草相互作用, 导致不同基因型的禾草-内生真菌共生体在不同空间范围内存在较大差异[34]。因此, 在不同的环境条件下, 垂直传播的禾草内生真菌感染同一宿主的能力在不同地理区域存在明显的差异。例如, 在发达的无性分蘖和强大的种子生产能力的共同作用下, 群落中处于优势地位的多年生禾草可在稳定的生境条件下获得较高的带菌率[34]。相反, 如果内生真菌和宿主间介于中性或者敌对关系时, 群落中禾草资源的带菌率往往较低或者不带菌。本研究中带菌率较高的醉马草通过与其侵染的内生真菌相互作用产生次生代谢物(麦角碱)使草食家畜和昆虫产生拒食性; 同时醉马草种子产量较高, 平均单株种子量就超过800粒, 从而有效提高整个种群的带菌率[35, 36, 37, 38, 39], 这与国外黑麦草和高羊茅种群具有较高带菌率的研究结果相似[7, 9, 15, 40, 41]。同时, 本研究中带菌率最高的紫花针茅作为青藏高原特有的禾本科植物, 在高寒草地中形成了以紫花针茅为单一优势种的植物群落[42, 43, 44], 紫花针茅具有较强的分蘖和种子生产能力, 同时在牧草种子成熟期, 种子形成的芒针能对家畜体表造成伤害, 降低家畜在种子形成期对紫花针茅采食, 从而使其种群不断更新和扩大[45, 46, 47]。
另外, 禾草内生真菌带菌率受到种子传播能力和环境温度的严格控制。例如, 紫花针茅种子成熟期, 芒两侧密被羽状毛极易粘附到家畜体表, 从而不断扩大带菌种群分布面积。本研究样点主要分布在北半球高寒地带, 海拔介于3 007 ~4 304 m(表1), 在海拔最高点只有毛稃羊茅带菌, 随着海拔降低, 温度逐渐升高, 带菌植物种类也明显增加, 这种现象在其他植物中也得出相似的结果。如, 巴拿马地区热带森林中树叶单位面积上内生真菌的多样性远远高于北极周围生长树木叶片内生真菌的多样性[48]。
在本次调查中, 虽发现有48种禾本科植物感染内生真菌, 但其中能纯培养分离得到内生真菌的禾本科植物只有4种(表3, 图1), 表明内生真菌分离率较低。这可能由以下原因造成:一方面植物或种子材料存放时间较长, 造成内生真菌活力丧失[23, 49]; 另一方面不同植物感染的内生真菌分离条件和培养基质存在差异[50, 51]。Li等[50]研究表明, 醉马草内生真菌在不同培养条件(温度、pH值)、营养配比和培养基上生长情况存在差异。本研究中, 只采用PDA培养基和常规培养条件, 可能是造成禾草内生真菌分离率较低的主要原因, 所以, 在今后开展的研究中尝试使用不同培养基、不同培养及营养条件来探索适合不同内生真菌分离的最佳条件, 为进一步开展禾草内生真菌分类学鉴定提供保障。
综上所述, 青海高原感染禾草内生真菌宿主较为丰富, 调查草地的主要建群种和特有种, 如:针茅属、芨芨草属、早熟禾属和羊茅属等禾草均不同程度地被禾草内生真菌侵染, 其中紫花针茅和醉马草带菌率最高; 然而内生真菌分离率较低, 同时, 分离得到的内生真菌之间存在形态上的差异, 这可能与其感染内生真菌种类不同有关。由于本研究只涵盖青海高原的部分地区, 后续的研究需要进一步扩大检测范围, 从而总结禾草内生真菌共生体在高原地区分布特点; 另外, 需对分离内生真菌, 尤其是高寒草地建群种— — 紫花针茅开展分子标记试验, 确定其感染内生真菌的分类地位, 并对内生真菌的宿主特异性进行研究, 为今后利用禾草内生真菌作为育种材料提供基础资料。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|