第一作者:邹吉祥(1986-),男,吉林白山人,助理工程师,硕士,研究方向为牧草组织培养与转基因育种。E-mail:zjx@dlnu.edu.cn
研究了不同浓度植物生长调节剂噻苯隆(Thidiazuron,TDZ)对解除羊草( Leymus chinensis)种子休眠和植株再生的影响,并对愈伤组织进行超微结构观察。结果表明,0.02 mg·L-1 TDZ低温浸种对解除羊草种子休眠和诱导胚性愈伤组织的效果最佳,发芽率和出愈率分别为11.0%和15.5%;羊草愈伤组织分化最佳培养基配方为MS+TDZ 0.5 mg·L-1+CH 2.0 g·L-1,分化率、绿芽分化率分别为56.7%和423.3%;TDZ低温浸泡处理的羊草种子诱导出的胚性愈伤组织较非胚性愈伤组织细胞质体中内含物丰富,更易于体胚形成;丛生芽经过1/2MS生根培养基的3次继代,炼苗移栽后成活率达100%。
In the experiment, dormancy release of Leymus chinensis seed and plant regeneration is studied using plant growth regulator TDZ with different concentrations, and ultramicro observations are conducted on callus. The results showed that 0.02 mg·L-1 TDZ cold soaking has the best effect on dormancy release of L. chinensis seed and embryonic callus induction. The germination rate and the healing rate are 11% and 15.5%, respectively, the best media component formula for L. chinensis callus differentiation is MS+TDZ 0.5 mg·L-1+CH 2.0 g·L-1, the differentiation rate and green shoot differentiation rate are 56.7% and 423.3%, respectively. Otherwise, transmission electron microscope (TEM) observations found that the embryonic callus induced by TDZ cold soaking, L. chinensis seeds contain more rich contents and are more conductive to body embryo formation than that of non-embryonic callus cell plasmid. After acclimatization and transplanting, the survival rate of the multiple shoots through 3 times of subculture with 1/2 MS rooting media is 100%.
羊草(Leymus chinensis)是经济价值较高的禾本科赖草属牧草, 被誉为“ 牧草之王” 。羊草自身存在“ 三低现象” (即抽穗率低、结实率低、发芽率低)[1], 导致难以利用常规杂交育种手段培育羊草新品种, 并且传统的育种方法存在周期长、工作量大、目的性差等缺点。因此, 迫切需要发展和利用现代生物技术, 加速羊草的育种研究, 并达到改良羊草的目的。禾本科牧草基因工程育种研究起步较晚, 羊草高频再生及遗传转化体系的研究还处于初步阶段, 且羊草种子休眠程度深[2], 休眠期长[3], 严重影响了利用转基因手段快速培育具有优良性状的羊草新品系, 而遗传转化改良技术的关键在于建立良好的高频再生体系。利用新型植物生长调节剂构建羊草高效植株再生体系对加速羊草新品种改良具有重要意义。
噻苯隆(Thidiazuron, TDZ)是一种人工合成的新型植物生长调节剂[4], 具有生长素和细胞分裂素双重作用的特殊功能[5, 6]。TDZ有类似生长素的作用, 在诱导外植体愈伤组织的形成和芽再生过程中均有强烈的促进作用[7, 8, 9, 10]。其细胞分裂素活性超过玉米素和6-BA几十倍至几百倍, 对种子萌发过程中酶活性的增加有促进作用, 能提高种子发芽率, 缩短要求经过低温阶段才能破除种子休眠的时间[11]。TDZ在禾本科中应用较少[12], 至今未见TDZ对解除赖草属种子休眠和促进羊草再生方面的研究报道。因此, 本研究以羊草成熟种子作为外植体, 利用TDZ对解除羊草种子休眠和植株再生进行分析, 筛选出羊草再生各个阶段的最佳TDZ浓度, 并采用透射电镜技术对胚性愈伤组织和非胚性愈伤组织进行观察, 以期建立高频稳定的羊草再生体系, 为下一步遗传转化工作奠定基础。
供试羊草种子于2010年8月采自吉林省吉生羊草良种站(43° 48'24.06″ N、125° 14'6.33″ E), 在5 ℃条件下贮藏备用。
1.2.1 种子预处理及愈伤组织诱导 将羊草种子人工去稃, 分别随机选取羊草种子50粒, 用不同浓度的植物生长调节剂TDZ(0.02、0.2、2.0 mg· L-1)低温5 ℃浸泡48 h, 用水浸泡处理作为对照, 70%酒精消毒1 min, 并用无菌水冲洗3遍, 然后用0.1%升汞消毒13 min, 无菌水冲洗5遍, 接入诱导培养基:MS+2, 4-D 2.0 mg· L-1+Gln 500 mg· L-1+蔗糖30 g· L-1, 4次重复, 28 ℃暗培养30 d后统计羊草种子的发芽率和出愈率。
1.2.2 愈伤组织分化 挑选生长良好的愈伤组织进行继代, 每隔7 d继代一次, 挑选继代一次后的胚性愈伤组织转入分化培养基中进行分化, 分化培养基为:MS+TDZ+CH 2.0 mg· L-1+蔗糖30 g· L-1, 其中CH为水解酪蛋白, TDZ的浓度分别为:0、0.2、0.5、1.0、2.0、3.0 mg· L-1。3次重复, 28 ℃暗培养7 d后进行光下培养, 1个半月后统计分化率。
1.2.3 愈伤组织的显微结构观察 将愈伤组织在无菌条件下用锋利的刀片切取3 mm3的小块, 3%戊二醛固定, 在冰箱中固定过夜, 用pH值7.2的0.2 mol· L-1磷酸缓冲液冲洗3次, 每次30 min, 再用30%、50%、70%、80%、90%、95%和100%的乙醇分别脱水30 min, 经醋酸异戊脂置换30 min后, 用CO2临界点干燥仪干燥, 在奥林巴斯CX21光学显微镜上进行结构观察。
1.2.4 透射电镜样品的制备与观察 将愈伤组织在无菌条件下用锋利的刀片切割成1 mm3的小块, 迅速放入3%戊二醛中, 在冰箱中固定过夜, 用pH值7.2的0.2 mol· L-1的磷酸缓冲液冲洗3次, 每次30 min, 再用1%四氧化锇固定, 30%、50%、70%、80%、90%、95%和100%的乙醇分别脱水30 min, 环氧丙烷过渡3次, 每次30 min, 然后分别用Epon812纯树脂包埋剂包埋, 70 ℃聚合12 h, 在德国莱卡UC7型冷冻超薄切片机上切片, 超薄切片收集在镍网上, 醋酸双氧铀染色, 在JEM-1010型透射电子显微镜观察和摄影, 进行超微结构分析。
1.2.5 组培苗的生根及移栽 当丛生芽长至3~4 cm时转入1/2 MS生根培养基, 每隔3 d继代一次, 待根系发达时, 将上盖打开进行炼苗3 d左右, 取出组培苗, 用清水洗去根部培养基, 移入蛭石和草炭为基质的营养钵中, 最后移栽至花盆, 1个月后统计成活率。
1.2.6 数据统计分析
发芽率=发芽数/接种的种子数× 100%;
出愈率=愈伤组织数/接种的种子数× 100%;
分化率=分化芽的愈伤组织数/接种的愈伤组织块数× 100%;
绿芽分化率=分化芽数/接种的愈伤组织数× 100%;
增殖系数=增殖后的丛生芽数/接种的愈伤组织数。
试验数据利用SPSS软件统计分析, 采用邓肯氏新复极差法进行数据差异显著性检测。
低温浸泡处理羊草种子的TDZ浓度对其发芽率影响较大(表1)。随着TDZ的处理浓度增大, 发芽率呈现出先升高后下降的趋势。当TDZ的处理浓度为0.2和0.02 mg· L-1时, 发芽率较高, 分别为11.5%和11.0%, 显著高于对照(P< 0.05)。当TDZ的处理浓度升高为2.0 mg· L-1时, 发芽率降低至4.5%, 发芽种子的生长状况较差。
| 表1 不同浓度TDZ低温浸泡羊草种子对种子生长状况的影响 Table 1 Influence of cold soaking with different concentrations of TDZ on Leymus chinensis seed growth |
不同浓度TDZ低温浸泡处理后的羊草种子胚性愈伤组织诱导率不同(图1)。当TDZ的处理浓度为0.02 mg· L-1时, 胚性愈伤组织诱导率最高, 为15.5%, 与对照差异不显著(P> 0.05)。当TDZ的处理浓度> 0.02 mg· L-1时, 随着TDZ浓度增加诱导率逐渐降低, 在TDZ的处理浓度为2.0 mg· L-1时, 胚性愈伤组织诱导率仅为4.0%。
胚性的愈伤组织在光下分化7 d后出现绿色芽点儿(图2 C、D), 40 d后分化出苗, 丛生芽多而密(图E)。不同TDZ浓度对分化效果影响较大(表2)。
| 表2 TDZ对羊草愈伤组织分化的影响 Table 2 Influence of TDZ on Leymus chinensis callus differentiation |
在培养基中添加一定浓度的植物生长调节剂TDZ对羊草愈伤组织分化均有促进作用, 随着TDZ浓度的增大, 分化率明显提高, 当TDZ浓度增大到1.0 mg· L-1以上时, 羊草愈伤组织的绿芽分化率随TDZ浓度的增加而降低, TDZ浓度增加到为3.0 mg· L-1时, 分化率下降至40%。当TDZ浓度为0.5 mg· L-1时, 分化率最高, 分化率和绿芽分化率分别达到56.7%和423.3%, 丛生芽极多, 此时的增值系数高达4.2, 显著高于其他处理(P< 0.05), 诱导分化出的丛生芽密集, 叶形正常, 叶色浓绿。
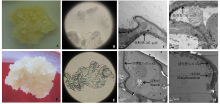
TDZ低温浸泡处理的羊草种子诱导出的胚性愈伤组织生长状态较好, 在分化过程中增值系数高, 胚性愈伤组织与非胚性愈伤组织的细胞表面结构、内部结构之间都存在很大的差异(图3)。显微结构观察发现, 非胚性愈伤组织细胞大小不一致, 性状不规则, 细胞之间不能组成细胞团(图3B), 而胚性愈伤组织细胞大小基本一致, 细胞之间结合紧密, 能够成细胞团(图3F)。通过透射电镜观察发现, 非胚性愈伤组织细胞形状不规则, 无淀粉粒和线粒体, 细胞内只有一些松散的小物质(图3C、D)。胚性愈伤组织细胞质浓厚, 细胞内富含淀粉粒以及大量的细胞器, 内含物丰富(图3G), 靠近细胞壁附近有大量球状的线粒体分布, 线粒体内嵴丰富(图3H)。
TDZ是一种能提高发芽率的新型植物生长调节剂, 能够有效解除种子休眠, 缩短种子的休眠时间[13]。本研究表明, 植物生长调节剂TDZ低温浸泡处理可解除羊草种子休眠、提高羊草胚性愈伤组织的诱导率, 作用效果与TDZ浓度密切相关, 其中, 较低浓度的TDZ低温浸泡处理羊草种子对解除羊草种子休眠的效果显著, 而过高浓度处理不利于羊草种子发芽。以往用TDZ处理禾本科牧草种子的报道较少, 但本研究发现TDZ有赤霉素(GA3)促进羊草种子发芽的相同表现[13]。羊草种子的愈伤组织是从胚芽的生长点起源的[14], 所以通过TDZ低温浸种处理提高羊草种子发芽率可间接提高羊草愈伤组织的诱导率。在多种植物培养体系中添加TDZ都表现出能诱导愈伤组织形成, 均高于其他植物生长调节物质的细胞增殖速率[11], 本试验利用TDZ低温浸泡处理羊草种子后, 在含有2.0 mg· L-12, 4-D的诱导培养基中进行愈伤组织诱导, 发现羊草种子吸收了低浓度的TDZ后可提高胚性愈伤组织的诱导率, 明显高于对照, 而高浓度的TDZ低温浸种不利于羊草胚性愈伤组织的形成, 在小麦(Triticum aestivum)等其他作物也出现相似现象[15], 因此, 只有低浓度的TDZ才适合羊草种子的前处理, 这可能与TDZ的高效活性密切相关。
TDZ单独使用可诱导羊草愈伤组织分化出大量丛生芽。TDZ的细胞分裂素活性高于其他植物生长调节剂[16], 在许多植物的试验中被证明是一种对芽的诱导极为有效的植物激素[17], 本研究首次将TDZ应用于羊草组织培养中, 在羊草愈伤组织分化过程中得到了较好的分化效果, 适宜的浓度(0.5 mg· L-1)可以很好的提高羊草愈伤组织分化率, 虽然高浓度的分化率、绿芽分化率、增殖系数均远高于对照处理, 但分化出的再生芽叶色不正常, 分化效果不理想。此外, TDZ对根的形成有抑制作用[18, 19], 在生根阶段需降低TDZ的浓度, 以确保羊草正常生根。TDZ与其他激素组合使用能否更加提高羊草再生率还需要进一步试验。
胚性愈伤组织的诱导和筛选是羊草再生的关键。本试验对TDZ低温浸泡处理的羊草种子诱导出的胚性愈伤组织与非胚性愈伤组织进行显微观察和透射电镜观察, 发现两种类型愈伤组织的细胞表面结构、内部结构均存在显著差别。显微结构观察发现胚性愈伤组织和非胚性愈伤组织细胞表面结构和细胞存在方式存在差别很大, 可通过细胞的形状和细胞之间紧密程度来初步判断是否为胚性愈伤组织。羊草的胚性愈伤组织宏观观察为乳白色、颗粒状、紧密状结构, 在超微结构下, 细胞内富含淀粉粒, 线粒体含量丰富, 内脊发达。淀粉在提供能量和营养方面起重要作用, 内峭数量越多贮备的能量越大, 为细胞的进一步分裂提供能量, 质体中淀粉的出现与胚胎发生潜能的实现密切相关[20]。非胚性愈伤组织宏观观察为白色、水渍状、疏松的结构。在超微结构下, 细胞形状不规则, 细胞质稀少, 只进行有限增殖, 细胞分裂能力弱, 没有胚胎发生能力。TDZ低温浸泡处理羊草种子诱导得到的胚性愈伤组织内含物丰富, 具有较强的分化能力, 对羊草愈伤组织分化及再生具有重要意义。本研究结果有助于对以成熟种子为外植体的羊草再生体系优化, 提高羊草的再生率。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|