第一作者:申枚灵(1992-),女,四川成都人,在读硕士生,主要从事微生物研究。E-mail:m18340485693@163.com
以新疆塔里木盆地的光果甘草( Glycyrrhiza glabra)根、茎、叶为试验材料,研究其内生放线菌的多样性,挖掘其中抗逆性强且具有促生潜力的菌株。采用8种分离培养基分离内生放线菌124株,结合传统形态学观察,选取32株代表菌株进行16S rRNA基因序列分析,并检测其耐盐、耐碱及耐旱性,同时对其产生长素(IAA)、铁载体和溶磷等促生能力进行检测。结果显示32株菌均属于链霉菌属( Streptomyces sp.)。菌株对盐浓度的耐受性随着盐浓度的增加而降低,有6.3%的菌株达到了嗜盐的程度。培养基pH由7.0向碱性和酸性变化均导致菌株生长率降低,由100.0%(pH 7.0)降低至3.1%(pH 5.0、pH 11.0)。PEG浓度增加至25%时,菌株生长率降低至56.3%,当PEG浓度达到35%时,菌株均不能正常生长。65.6%的菌株能够分泌IAA,50%的菌株具有产铁载体的能力,25%的菌株具有溶磷能力。该结果表明,链霉菌属是塔里木盆地甘草内生放线菌的优势菌群,不仅具有较强的抗逆性,也具有促进植物生长的潜力。
Endophytic actinobacteria isolated from roots, stems, and leaves of Glycyrrhiza glabra in the Tarim basin, Xinjiang were analyzed for diversity, stress resistance, and ability to promote plant growth activity. A total of 124 endophytic actinobacteria were isolated from 8 media. Based on traditional morphological observation, 32 representative strains were selected for 16S rRNA sequencing. According to the phylogenetic analysis, all of the strains belonged to Streptomyces sp. Subsequently, stress resistance and the ability to promote plant growth activity were evaluated. The results showed that the salt tolerance of strains decreased with increasing salt concentration, and 6.3% of the strains were able to tolerate 15% NaCl concentrations. All of the strains were able to grow on media of pH 7.0; however, only 3.1% could grow on media of pH 5.0 and pH 11.0, respectively. With a polyethylene glycol (PEG) concentration of 25%, the growth rate of strains decreased to 56.3%. When the PEG concentration reached 35%, strains were unable to grow normally. Moreover, 65.6% of the strains could produce indole-3-acetic acid, 50% of the strains had the ability to produce siderophores, and 25% of the strains were able to dissolve phosphorus. The results showed that Streptomyces sp. was the dominant genera of endophytic actinobacteria, and not only possessed strong resistance, but also had plant growth-promoting activity.
植物内生菌(Endophyte)是指其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部对宿主植物不构成危害的微生物[1]。内生菌广泛存在于各种植物的内部组织中[2], 在与植物的长期共同进化中, 已成为植物微生态系统的天然成份, 它促进植物对营养的吸收、适应恶劣的生存环境、抵御病原体的侵害, 加强寄主植物体内系统的生态平衡[3], 具有重要的生态学作用。放线菌是植物内生菌的重要组成部分, 是抗生素及其他生物活性物质的重要来源。除此之外, 放线菌产生的耐热和抗干燥孢子可以在不利环境下长期存活[4], 具有一定的抗逆性, 且有大量研究表明, 植物内生放线菌可以通过多种促生机制促进植物生长[5, 6]。甘草(Glycyrrhiza uralensis)为豆科甘草属多年生草本植物, 喜干燥气候, 耐寒, 多生长于干旱、半干旱的荒漠草原, 黄土丘陵地带以及地下水位低的砂质中性或微碱土壤, 是新疆荒漠区最主要的植被物种之一[7], 在干旱脆弱的环境中起着防风固沙, 保持水土, 调节气候等重要作用[8]。在中国, 甘草有着悠久的药用历史, 是最常用的中草药品种, 具有益气补中、清热解毒、祛痰止咳, 调和诸药等功效[9]。甘草能在塔里木盆地盐碱荒漠地区广泛生长, 其内生菌在与宿主协同进化过程中可能同样具有耐盐碱、干旱等抗逆能力。但是, 目前国内外对塔里木盆地甘草内生菌的研究多集中于抗菌活性及产生活性物质等方面, 鲜有抗逆和促生等功能的报道。因此, 本研究以塔里木盆地的光果甘草为研究对象, 分离样品中的内生放线菌, 研究内生放线菌的多样性, 筛选出具有抗逆和促生功能的菌株, 为生物肥料的开发提供菌种资源, 以期提高甘草在盐碱荒漠和盐渍化弃耕地中的人工种植量, 从而更好地保护生态环境, 实现农业的可持续发展。
1.1.1 样品 从塔里木盆地(40° 33'51″ N, 80° 19'55.3″ E)随机采集15份生长健康的野生光果甘草植物样品。将植物根表的土壤去除, 有切口的部位用乙醇消毒, 再用蜡封好, 放入无菌塑料袋中, 保存于4 ℃冰盒中带回实验室, 立即进行分离。
1.1.2 主要试剂和仪器 溶菌酶、蛋白酶K、MIX、SDS、Tris、EDTA、 16SrRNA扩增引物(8-27f、1523-1504R)均购自上海生工生物工程有限公司; PCR仪、凝胶成像系统、电泳仪购自Bio-Rad公司; 其余试剂均为国产分析纯试剂。
1.1.3 培养基 采用8种分离培养基[10, 11, 12, 13]分离样品内生放线菌:LNMS培养基(H1)、ISP3培养基(H2)、HV培养基(H3)、棉子糖-组氨酸培养基(H4)、高氏Ⅰ 号培养基(H5)、改良高氏Ⅱ 号培养基(H6)、SCN培养基(H7)、葡萄糖-天冬氨酸培养基(H8), 分别向培养基中添加25 mg· L-1 K2Cr2O7, 25 mg· L-1安苄青霉素(enzyl peniciliin)作为细菌和真菌的生长抑制剂。
菌株纯化、活化、保藏培养基:ISP4培养基。
菌株促生作用筛选试剂:生长素(IAA)显色液、CAS检测液、蒙金娜培养基均参考文献[11]的方法进行配制。
1.2.1 植物内生放线菌分离、纯化 将采集的甘草样品进行严格的表面消毒及消毒效果检测[14]。把已经表面灭菌的植物样品, 分成根、茎、叶三部分, 置于无菌研钵中捣碎后, 均匀的铺撒在分离培养基上, 放入28 ℃隔水式培养箱内培养。待放线菌长出后, 用ISP4培养基进行菌落纯化, 并将纯化好的菌株保存于ISP4斜面培养基上, 4 ℃保存备用。
1.2.2 菌种初步鉴定 观察菌落的外部形态如:气丝、基丝、产生色素的颜色及扩散方式、有无孢子产生、是否吐水等情况。接种菌株于ISP4培养基埋片培养7~10 d, 革兰氏染色后用光学显微镜(Zeiss Axio Imager)观察菌丝形态, 同时对样本进冷冻干燥[15]、镀金, 于扫描电镜(Zeiss EVO 18)下观察, 对分离菌进行初步分类。
1.2.3 代表菌株16S rRNA 基因系统发育分析 根据菌株的形态特征, 选取了代表性菌株进行16S rRNA基因系统发育分析。采用文献[16]的方法提取代表性菌株DNA并进行PCR扩增。PCR产物送往生工生物工程上海(股份)有限公司进行测序, 测序获得的16S rRNA基因序列与GenBank数据库中的已知序列进行BLAST比对, 用Clustal X(Version 1.81)进行序列的多重比对分析, MEGA 6.0软件构建Neighbor-Joining系统进化树[17], 确定放线菌的分类地位。
1.2.4 甘草内生放线菌抗逆特性测定 甘草内生放线菌耐盐性检测:制作NaCl浓度为0、5%、7%、10%、15%、20%的6种ISP4固体培养基, 将供试菌株悬液用无菌牙签点到培养基上, 重复3次, 28 ℃培养5~7 d, 观察每株内生放线菌的生长情况并记录结果。
甘草内生放线菌耐酸碱性检测:以高氏一号培养基为基础, 用NaOH、KH2PO4、Na2CO3、KCl、NaHCO3、Na2HPO4· 10H2O、柠檬酸钠、柠檬酸三钠配置pH反应缓冲液, 使培养基的pH分别达到4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0, 将供试菌株菌悬液用无菌牙签点到培养基上, 做3个重复, 28 ℃培养5~7 d, 观察每株内生放线菌的生长情况并记录结果。
甘草内生放线菌耐旱性检测:耐旱放线菌的初筛试验采用聚乙二醇(PEG-6000)人工模拟干旱条件进行, 用不同浓度的PEG-6000制作ISP4培养基, 试验设置以下 4 个不同浓度的PEG-6000水平的干旱胁迫液:不加 PEG-6000(对照); 15%PEG-6000; 25% PEG-6000; 35% PEG-6000, 对应的水势分别为:0、-0.278、-0.699、-1.309 MPa。加入PEG-6000的量参照文献[18]方法。将供试菌株菌悬液用无菌牙签点到培养基上, 重复3次, 28 ℃培养5~7 d, 观察每株内生放线菌的生长情况并记录结果。
1.2.5 甘草内生放线菌促生特性测定 产IAA能力检测:菌株产IAA能力参考Gordon和Weber[19]的方法进行测定; 产铁载体能力检测:定性测定菌株产铁载体能力参照Shin等[20]的方法进行; 溶磷能力检测:将供试菌株接种到PKO培养基上, 每株菌重复3次, 置于28 ℃培养7 d, 观察有无解磷圈及解磷圈的大小。
采用Excel 2013对所测数据进行统计分析和图表制作。
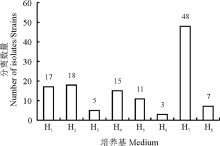
采用8种分离培养基从光果甘草的根、茎、叶中共分离得到内生放线菌124株, 编号为SCAU7001-SCAU7124。不同分离培养基分离得到的内生放线菌数目有较大的差异(图1), 分离得到放线菌最多的培养基是H7(SCN), 共分离得到48株放线菌, 其次是H2(ISP3)、H1(LNMS)、H4(棉子糖-组氨酸)、H5(高氏Ⅰ 号)、H8(葡萄糖-天冬氨酸)、H3(HV), 从H6(改良高氏Ⅱ 号)中分离得到的内生放线菌数量最少, 共3株。
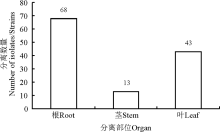
此外, 甘草属内生放线菌在植物不同部位的分布也有较大的差异(图2), 在植物根和叶中内生放线菌数量较之甘草属植物茎中的放线菌更为丰富。从根部分离的内生放线菌数量最多, 占总数的54.8%, 而茎中分离到的内生放线菌数量仅占10.5%。
所得菌株在培养基上均产生气生菌丝和基内菌丝, 根据气丝、基丝的颜色差异, 将124株内生放线菌初步分为白孢类群、灰色类群、桔红色类群、粉红孢类群、灰褐色类群, 其中24株具有吐水的特征。从中选取32株代表菌株, 显微观察菌株具有柔曲、螺旋、顶端卷曲呈球状的孢子链, 呈明显的链霉菌特征(图3)。
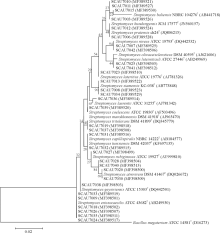
根据菌株的形态特征, 选取了32株代表菌株进行16S rRNA基因序列扩增。结果表明32个代表菌株都属于链霉菌属, 链霉菌属为甘草属植物内生放线菌的优势种群(图4)。
将甘草内生放线菌的菌悬液分别点到不同盐浓度的高氏一号培养基上, 发现在盐浓度为0时所有菌株均能生长。在盐浓度为5%、7%、10%、15%的培养基上部分菌株能够生长, 且随着盐浓度的变大, 内生放线菌的耐受性越差, 能够生长的菌株数量百分比依次为75%、40.6%、18.8%、6.3%。在盐浓度为20%的培养基上无菌株生长。其中菌株SCAU7023和SCAU7036能够在盐浓度为15%的培养基上生长, 基于极端盐环境为盐浓度大于120 g· L-1的定义[21], 表明在极端盐环境条件下, 菌株SCAU7023和SCAU7036内生放线菌具有较强的耐受能力(表1)。
对32株甘草内生放线菌耐酸碱性检测结果显示:当pH为4.0或12.0时, 无菌株生长, 在pH为7.0的培养基上, 所有放线菌均能正常生长。培养基pH由7.0向碱性或酸性变化均导致内生放线菌生长率降低, 在pH为5.0、6.0、8.0、9.0、10.0和11.0的培养基上能够生长的菌株数量百分比依次为3.1%、75%、90.6%、62.5%、18.8%和3.1%, 由此可见甘草内生放线菌对碱性环境的耐受性好于酸性环境。此外, 仅菌株SCAU7023能够在pH为11.0的培养基上生长, 结合耐盐性检测结果, 表明该菌株具有较强的耐盐碱性能力(表1)。
| 表1 甘草内生放线菌代表菌株的耐盐性、耐酸碱性及耐旱性 Table 1 Resistance to salt, acid, alkali, and drought in the endophytic actinobacteria of liquorice |
将内生放线菌接种至4个不同PEG-6000浓度的ISP4培养基上, 当PEG-6000浓度为15%时, 内生放线菌的存活率高达87.5%, PEG-6000 浓度为25%时存活率为56.3%。然而, 随着PEG-6000浓度的增加, 水势不断降低, 能生长的内生放线菌数量越来越少, 长势也越来越差(表1)。当PEG-6000浓度达到35%时, 内生放线菌均不能正常生长, 表明在水势为-1.309 MPa的干旱环境下, 甘草内生放线菌难以生存。
对32株甘草内生放线菌代表菌株促生功能进行检测, 测得32株内生放线菌中有65.6%的内生放线菌能分泌IAA, 分泌的IAA浓度范围为4.32~28.63 mg· L-1, 其中菌株SCAU7019、SCAU7033、 SCAU7038分泌的IAA浓度都在20 mg· L-1以上, 菌株SCAU7033分泌的IAA浓度最高。将32株内生放线菌接种到CAS平板上, 共有16株内生放线菌菌落周围出现黄色晕圈, 占总数的50%, 其中菌株SCAU7011、SCAU7027、SCAU7036、SCAU7037产生了2 mm以上的水解圈(表2)。32株内生放线菌中仅有8株菌在PKO平板上出现解磷水解圈, 且水解圈均小于2 mm。32株甘草内生放线菌中具有1项以上促生功能的菌株占90.6%, 且菌株SCAU7019、SCAU7027、SCAU7036同时具有产IAA、产铁载体、溶磷3项促生功能, 具有产IAA能力的菌株在植物的根、茎、叶中均有分布, 但具有产铁载体和溶磷作用的菌株却大部分分离自植物根部。
| 表2 甘草内生放线菌促生功能检测结果 Table 2 Results of the growth-promoting analysis of the endophytic actinobacteria of liquorice |
适宜的培养基对研究植物内生可培养放线菌的多样性至关重要。培养基中各营养成分不同, 因此从不同的培养基中分离得到的放线菌数量与种类也不尽相同, 本研究采用8种分离培养基从采自新疆的光果甘草中分离得到内生放线菌124株, 其中H7(SCN)培养基分离出的放线菌数量最多, 其次是H1(LNMS)、H2(ISP3)培养基, 而从H6(改良高氏Ⅱ 号)中分离得到的内生放线菌数量最少, 表明放线菌偏好无机盐营养的培养基质。对32株代表性菌株的16S rRNA测序结果及系统发育分析表明, 在甘草属植物不同部位中的, 链霉菌属放线菌属于优势菌群, 不仅数量大, 而且种类丰富, 表明塔里木盆地甘草内生放线菌在链霉菌属内的多样性很高, 链霉菌属在这一特殊的生境中具有较强的适应能力。有大量研究结果显示[22, 23], 从不同环境的草本植物中分离得到的放线菌大多为链霉菌, 表明链霉菌不仅是甘草内生放线菌中的优势种群, 同样广泛存在于各种生境和各种植物体内。Zhao等[24]对塔里木盆地光果甘草内生放线菌多样性的研究中分离到了4个属的放线菌, 其多样性高于本研究, 分析原因可能是植物内生放线菌的分离受采样时间、生长环境、宿主的年龄、生长健康状态、培养基种类等诸多因素的影响。因此, 要想全面了解植物内生放线菌种类及分布情况, 不仅要选择具有不同的碳源、氮源及营养成分类型各异的培养基质, 满足不同类型放线菌生长的需要, 还应该将年龄、生长状态及生境有差异的宿主植物纳入研究范围中, 以期从植物中分离得到更多更有用的放线菌资源。除此之外, 植株不同部位的内生放线菌数量和种类也不尽相同。从不同组织中分离内生放线菌的结果来看, 不同部位内生放线菌的数量和种类存在较大差异。根部的内生放线菌数量和种类均比叶、茎部丰富, 而叶的丰富度又高于茎, 与李丽等[25]人的研究结果一致, 说明内生放线菌在宿主植物中的定殖部位有一定的选择性, 推测根部的内生放线菌丰富度高主要是因为根部长期处于土壤环境中, 与根际微生物“ 交流” 频繁, 大量的根际放线菌通过吸附、渗透等方式侵染宿主植物[26], 并与宿主植物长期共处, 定殖于根部。
经过检测, 塔里木盆地甘草内生放线菌对各盐浓度、酸碱度、干旱程度都表现出一定的耐受性, 表明所分离的放线菌具有较好的抗逆性。大多数内生放线菌能在0~7%的盐浓度, pH为6.0~9.0的酸碱度, 以及PEG浓度为0~25%的环境下生长, 其原因可能是甘草主要生长在中国北部和西部的干旱荒漠地区, 有很强的抗逆性, 其内生菌在与宿主协同进化过程中同样可能具有耐盐碱、干旱等抗逆能力。表明在独特环境中生长的植物及其内生菌由于长期适应特殊环境, 形成了一些独特的生长、生理机制和遗传基因[27]。植物内生菌作为植物体内特殊的共生生物, 在大多数情况下, 它们之间是互惠共生的, 一方面内生菌通过植物体获得营养物质、庇护和传播; 另一方面寄生的内生菌可能通过产生大量的生物活性物质或借助于信号转导对宿主植物提供保护, 增强植物抗病、抗虫、抗干旱胁迫等能力[28]。东乡野生稻(Oryza rufipogon)是迄今所发现的世界上分布最北的野生稻, 具有抗寒、耐旱、耐瘠、抗虫等优良品质, 除了其优良的遗传基因外, 内生菌也被认为与这些优良品质有一定的关系[29]。周达[30]更是提出了内生菌对提高逆境胁迫下甘草生长的科学依据, 在其对宁夏乌拉尔甘草内生菌的抗逆特性的研究中发现:菌株G2(Bacillus licheniformis)、G5(B. pumilus)能够在试验设定最高盐浓度(13%)和最低pH 5和最高pH 11条件下生长, 进一步研究发现, 菌株G2 、G5可以缓解盐和干旱胁迫下对种子萌发的抑制, 菌株G2可以缓解盐胁迫对甘草幼苗根和茎生长的抑制。其作用机制主要为菌株G2、G5可以缓解盐胁迫所造成的甘草体内自由氧增多, 在干旱条件下通过提高抗氧化酶活性来促进甘草幼苗清除过多的自由氧。菌株G2 、G5在盐胁迫下可以通过提高脯氨酸含量促进甘草幼苗对渗透物质的调节。
大量研究表明, 内生放线菌还能通过分泌IAA、产生铁载体、溶磷、固氮等作用促进植物的生长发育[31, 32]。本研究对32株代表菌株进行促生功能评价发现, 具有产IAA作用的菌株在植物的根、茎、叶中均有分布, 但具有产铁载体和溶磷作用的菌株却大部分都分离自植物根部。植物内生放线菌能够通过产IAA、产铁载体、溶磷等作用直接或间接地促进植物的生长和增加根部活动强度, 菌株分泌IAA刺激细胞伸长和分裂从而直接促进植物生长, 同时通过分泌次生代谢产物溶解土壤中的磷矿物为植物生长提供养分, 还可以通过产铁载体螯合土壤中游离的铁使土壤中可用的铁降低至更为缺乏的程度, 使病原真菌的繁衍和侵染能力大大下降从而间接促进植物生长[33]。因此, 可以解释具有产铁载体和溶磷作用的菌在根部分布较多这一现象。此外, Egamberdieva等[34]的研究发现:植物生长激素(赤霉素、生长素、玉米素和乙烯)可以提高盐胁迫下小麦种子的萌发率, 且产IAA的菌株可以减轻土壤中的盐分对小麦生长的胁迫并促进植物生长。因此, 植物内生菌能够通过产生相应的植物激素来提高宿主植物的抗逆性, 这也可能是本研究能够从塔里木盆地的甘草中分离获得大量产IAA的内生放线菌的重要因素。本研究结果显示, SCAU7019、SCAU7027和SCAU7036这3株内生放线菌同时具有产IAA、铁载体和溶磷的能力。此外, 这3株菌在耐盐性、耐酸碱性及耐旱性的检测中都表现出了一定的抗性, 表明塔里木盆地甘草内生放线菌不仅具有较强的抗逆能力, 而且具有促进植物生长的潜力。
(执行编辑 苟燕妮)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|