第一作者:刘晨旭(1989-),女,山东德州人,助教,硕士,主要从事园林植物种质资源研究。E-mail:dzzylcx@126.com
CBF是一类植物特异性、具有多种功能的转录因子。本研究将从甘菊( Chrysanthemum lavandulifolium)中分离的 ClCBF1基因构建到植物表达载体pBI121上,并采用农杆菌介导的花序浸染法对拟南芥( Arabidopsis thaliana)进行遗传转化,共获得4个转基因株系经过抗性筛选和RT-PCR验证,对其中表达量较高的3个转基因株系进行研究,结果表明:在150 mmol·L-1甘露醇培养基中转基因拟南芥的种子萌发率和根长平均为野生型的2.0倍和1.2倍,在150 mmol·L-1NaCl培养基中转基因拟南芥种子萌发率和根长平均为野生型的1.1倍和1.4倍;在干旱和盐胁迫条件下,转基因拟南芥幼苗的成活率高于野生型,并且超氧化物歧化酶(SOD)和过氧化物酶(POD)活性显著高于野生型( P<0.05),丙二醛(MDA)含量及相对电导率显著低于野生型植株( P<0.05)。说明 ClCBF1基因在拟南芥受到干旱和盐胁迫过程中发挥一定作用。
The C-repeat-binding-factor (CBF) is a class of plant-specific transcription factors with multiple functions. In the present study, the ClCBF1 gene isolated from Chrysanthemum lavandulifolium was constructed using the plant expression vector pBI121, and Agrobacterium-mediated was used to genetically transform Arabidopsis thaliana. Four transgenic lines were obtained. After resistance screening and RT-PCR, three transgenic lines with high expression were studied. The results showed that the seed germination rate and root length of transgenic A. thaliana were 2.0 times and 1.2 times higher than that of wild type in 150 mmol·L-1 mannitol medium, respectively, whereas the seed germination rate and root length of transgenic A. thaliana were 1.1 times and 1.4 times higher than that of wild type in 150 mmol·L-1 NaCl medium, respectively. Under drought and salt stress, the survival rate of transgenic A. thaliana seedlings was higher than that of the wild type seedlings, and the activity of superoxide dismutase (SOD) and peroxidase (POD) was significantly higher than that of the wild type. The MDA content and relative conductivity were significantly lower in transgenic A. thaliana seedlings than that in wild type seedlings ( P<0.05). These results indicate that the ClCBF1 gene plays a role in A. thaliana under drought and salt stressconditions.
甘菊(Chrysanthemum lavandulifolium)是菊科菊属的二倍体植物[1]。随着自然环境的日渐恶化和社会对园林需求的日益提高, 对于园林植物的观赏性及抗逆性也有了更高的要求, 甘菊作为园林植物之一, 其抗性基因资源已经引起科研工作者的广泛关注。目前, 关于甘菊抗旱、耐盐等对抗非生物逆境基因功能的相关研究已经取得了一些进展, 有研究发现在甘菊中响应盐胁迫的主要调节功能基因组群[2]; 另有研究在甘菊中鉴定了DlNAC1基因, 证明其在低温、干旱和高盐条件下可以被诱导[3]; 此外, 还陆续发现了甘菊中受多种非生物逆境条件诱导表达的ClCBL基因[4], 部分受高盐和干旱诱导表达的ClNUDX基因[5]等。甘菊中所蕴含的丰富抗性基因资源在提高园林植物适应性和使更多植物应用在瘠薄环境的绿化方面具有巨大的研究潜力和价值, 值得进行进一步的研究发掘。
CBF是一种在逆境条件下能特异性激活下游含有CRT/DRE(C-repeat dehydration-responsive element)顺式作用元件, 从而提高植物抗逆性的转录因子[6], 主要由60个氨基酸组成, 由此形成1个α 螺旋和3个β 折叠, 该结构能够结合COR基因启动子中的CRT/DRE片段, 从而诱导COR基因表达[7]。CBF类转录因子一般与干早、高盐或低温胁迫条件下应答基因的启动子结合, 催化与诱导这类抗性基因进行表达, 进而提高植物的抗逆性。有研究表明, 过量表达棉花(Gossypium hirsutum)GhCBF2提高了拟南芥(Arabidopsis thaliana) 对于干旱和盐的耐受性[8], 在拟南芥中对CBF基因进行过表达, 转基因植株对盐胁迫耐受性显著增强[9]。
东北林业大学园林学院菊花课题组前期在甘菊中克隆获得了一个在植物对抗逆境胁迫过程中起到重要作用的CBF转录因子ClCBF1, 该基因编码210个氨基酸, 具有AP2结构域, 属于AP2基因家族成员, 对其进行表达模式分析, 得知ClCBF1受冷、热、盐等胁迫诱导[10]。本研究拟在菊花课题组前期工作的基础上, 将ClCBF1基因构建到植物表达载体并转化到拟南芥中, 对其进行抗旱耐盐能力试验, 以此来探讨ClCBF1基因的调控功能, 以期为培育抗旱耐盐性强的新品系提供理论研究基础。
遗传转化中使用的野生型拟南芥种子(Col-0型)由北京林业大学园林学院馈赠, 野生型拟南芥(WT)种子依次使用70%酒精和2%次氯酸钠溶液消毒并用灭菌水吸打冲净。所用根癌农杆菌(Agrobacterium tumefacien)菌株GV3101为寒区园林植物种质资源开发与景观生态修复黑龙江省重点实验室保存。胁迫抗性检测所用植物材料为转CBF1基因拟南芥T3代种子。
植物表达载体pBI121-ClCBF1的构建参考徐春波等[11]的方法。拟南芥生长至抽薹开花时, 即可采用农杆菌介导法进行遗传转化。使用含50 mg· L-1卡那霉素的1/2MS培养基对T0代种子进行抗性植株筛选。用Trizol法提取T1代植株叶片总RNA并进行反转录, 以拟南芥ACT2基因(AT3G18780)为内参进行PCR, 对各株系中CBF1基因的转录情况进行检测。特异引物序列为:
CBF1-BamHI:TAGGATCCATGGACATGAACAA;
CBF1-SalI:GCGTCGACGTAACTCCATAACG.
1.3.1 转基因拟南芥种子萌发率和根长的测定 将WT和T3代转基因拟南芥ClCBF1-3、ClCBF1-4、ClCBF1-5共3个株系种子4 ℃处理48 h, 消毒并播于含0、50、100、150、200 mmol· L-1甘露醇的1/2MS培养基上, 以WT为对照, 观察、统计种子萌发率, 每个处理重复3次。7 d后把植株分别转移到相同胁迫梯度的1/2MS培养基中竖直培养, 观察并统计根长生长情况。
1.3.2 转基因拟南芥幼苗抗旱性测定 将WT和T3代转基因拟南芥3个株系种子4 ℃处理48 h, 消毒, 播种于1/2MS培养基中, 20 d后植株长到4片真叶时, 将其移栽入蛭石∶ 营养土=1∶ 1的花盆中, 50 d后开始对其进行自然干旱处理, 胁迫15 d后取植株叶片测定生理指标, 每个指标取3株植株进行重复。成活率、相对电导率的测定参考曹忠慧[12]的方法, 丙二醛(MDA)含量、超氧化物歧化酶(SOD)和过氧化氢酶(POD)酶活性的测定参考李合生[13]的方法。
1.4.1 转基因拟南芥种子萌发率及根长测定 盐胁迫下拟南芥种子萌发率和根长的测定试验方法同1.3.1, 1/2MS培养基中NaCl的浓度分别为0、50、100、150、200 mmol· L-1。
1.4.2 转基因拟南芥幼苗耐盐性测定 拟南芥的培养过程及生理指标测定试验方法同1.3.2, 盐胁迫采用200 mmol· L-1NaCl溶液浇灌15 d的方法。
使用SPSS 19.0和Excel 2007进行试验数据的计算和统计分析, 用Duncan法进行差异显著性分析。
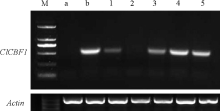
通过花序浸染法转化拟南芥, 转基因拟南芥经过卡那霉素抗性筛选共得到5个株系(图1)。经过PCR检测, WT和转基因株系ClCBF1-2中没有检测出目的基因条带, 其余转基因植株与质粒PCR出的特异条带一致, 进一步证明目的基因已经在RNA水平表达。选取表达量较高的3个转基因株系ClCBF1-3、ClCBF1-4、ClCBF1-5进行干旱及盐胁迫耐性分析。
2.2.1 干旱胁迫对转基因拟南芥种子萌发率的影响 在没有添加甘露醇的1/2MS培养基中, WT和转基因种子的萌发率均为100%(图2)。随着甘露醇浓度逐渐升高, WT种子萌发率逐步显著下降, 转基因型萌发率在100和150 mmol· L-1时略有下降, 随后在200 mmol· L-1时明显降低, WT种子萌发率降至29.4%, 转基因拟南芥株系ClCBF1-3、ClCBF1-4、ClCBF1-5分别为65%、61%和62%, WT降低幅度大于转基因型; 通过观察可知, 在较高浓度甘露醇中, WT叶片较为细小, 颜色失绿发黄, 转基因型生长良好。由此可见, 转基因拟南芥种子在萌发阶段对干旱的抗性强于WT。
2.2.2 干旱胁迫对转基因拟南芥根长的影响 甘露醇浓度较低时, WT和转基因植株的根长均没有受到明显影响(图3), 100 mmol· L-1时各株系根长有不同程度的降低, WT根长下降幅度最大且根长最短(P< 0.05), 随着甘露醇浓度的升高, 根长的增长被抑制, 植株叶片颜色加深, 甘露醇浓度在150、200 mmol· L-1时, 转基因植株的根长大于WT(P< 0.05), 且须根显著多于WT。以上说明, 转入的CBF1基因提高了拟南芥对干旱胁迫的抵抗力。
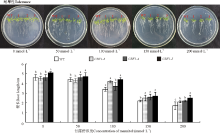 | 图3 干旱胁迫对野生型植株(WT)和转基因拟南芥株系(CBF1-3、CBF1-4、CBF1-5)根长的影响Fig. 3 The roots length of transgenic Arabidopsis thaliana treated (CBF1-3, CBF1-4, CBF1-5) with mannitol |
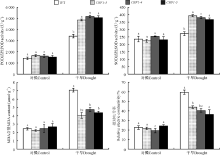
2.2.3 干旱胁迫对转基因拟南芥表型及生理指标的影响 干旱胁迫15 d后, WT叶片黄化细小、部分干枯, 存活率为33.5%; 而转CBF1基因的拟南芥叶片黄化程度远低于WT(图4)。干旱处理拟南芥的生理指标如图5所示, 当植株未受到胁迫时WT和转基因拟南芥各酶活性基本持平, 植株受到干旱处理后转基因拟南芥酶活性显著大于WT植株(P< 0.05)。而WT和转基因植株未受到干旱胁迫时MDA和电导率差异不显著(P> 0.05), 在受到干旱胁迫后WT的MDA和电导率增大幅度大于转基因拟南芥(P< 0.05), 这说明转入的CBF1基因提高了拟南芥的抗旱性。
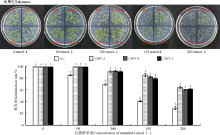
2.3.1 盐胁迫对转基因拟南芥种子萌发率的影响 当NaCl浓度为0和50 mmol· L-1时, 各株系种子萌发率均为100%(图6)。随着NaCl浓度逐渐升高, WT和转基因型种子萌发率先略微降低, 然后大幅下降, 当NaCl浓度达到200 mmol· L-1时, WT降至18%, 转基因分别降至16%、19%和21%。在较高浓度NaCl胁迫下, 拟南芥叶片短小、发黄略白, WT植株更为明显。由此可见, CBF1基因提高了拟南芥种子萌发期受到盐胁迫时的耐受性。
 | 图6 野生型株系(WT)与转基因拟南芥(CBF1-3、CBF1-4、CBF1-5)种子萌发时期耐盐性及萌发率情况Fig. 6 Salt tolerance and germination rate of transgenic Arabidopsis thaliana (CBF1-3, CBF1-4, CBF1-5) during germination |
2.3.2 盐胁迫对转基因拟南芥根长的影响 NaCl浓度在0和50 mmol· L-1时, WT和转基因植株的根长均在5.7 cm左右, 没有受到盐胁迫的明显影响(图7); 在NaCl浓度较高时各株系根长出现显著下降, WT下降幅度最大且根长最短, 转基因植株根长均显著高于WT(P< 0.05)。随着NaCl浓度的增加, 根部逐渐变得短而细小, 植株叶片细小发白出现死亡迹象, 这表明, 转入的CBF1基因提高了拟南芥根长生长过程的耐盐性。
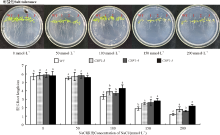 | 图7 不同浓度NaCl处理下野生型株系(WT)与转基因拟南芥(CBF1-3、CBF1-4、CBF1-5)根长情况Fig. 7 Rootlengths of transgenic Arabidopsis thaliana (CBF1-3, CBF1-4, CBF1-5) treated with NaCl |
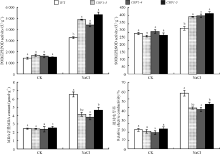
2.3.3 盐胁迫对转基因拟南芥表型及生理指标的影响 NaCl溶液浇灌处理后, WT大部分叶片发黄失绿、甚至干枯死亡; 而转CBF1基因拟南芥少部分叶尖黄化, 大部分生长正常(图8)。未胁迫时WT和转基因拟南芥MDA含量、相对电导率和酶活性均差异不显著(P> 0.05), 在盐胁迫下, 转CBF1基因拟南芥各株系酶活性均显著高于WT(P< 0.05), WT的MDA含量和电导率显著高于转基因拟南芥(图9), 说明WT由于受到了盐胁迫而积累了大量MDA。综上, CBF1基因提高了拟南芥对于盐胁迫的耐受能力。
植株在生命过程中会经历各种逆境胁迫, 这些逆境条件会对植物的生理生化和生长发育造成伤害。CBF转录因子与植物的抗逆性密切相关, 在植物处于逆境条件时可对逆境胁迫相关基因的表达起调控作用, 从而增强植物的抗逆性[15]。研究表明, 从棉花中分离得到的GhCBF2基因在拟南芥中过量表达, 提高了转基因拟南芥对盐和干旱胁迫的抗性[11]; 二穗短柄草(Brachypodium distachyon) CBF2基因提高了拟南芥对干旱的抗性[16]; 过表达IbCBF3可增加转基因甘薯(Ipomoea batatas)对低温和干旱胁迫耐受性[17]; 转CBF1基因番茄(Lycopersicon esculentum)体内脯氨酸含量上升, 植株对低温和干旱的耐受性都明显提高[18]。本研究在前期工作的基础上, 从甘菊中分离得到在逆境胁迫中能够有效调控植物应答的ClCBF1基因转入拟南芥, 结果表明转基因拟南芥对盐和干旱耐受性增强。
在受到干旱胁迫时, 植株会通过多种内源激素的响应[19]、抗氧化酶系统调节活性氧平衡、渗透物质调节细胞渗透压[20]等多种方式对逆境胁迫进行生理响应。在前人研究中将CBF1基因转入棉花, 对其进行耐旱性研究, 在不同程度的干旱胁迫下, 转基因棉花的生长情况明显强于野生型, 表明转入的CBF1基因有效增强了棉花对于干旱胁迫的耐受性[21]。本研究中, 干旱处理下WT的MDA含量显著升高, 转基因植株的升高幅度较为平缓, 转基因3个株系细胞膜破坏程度相对较弱, 使得MDA含量和相对电导率均低于WT植株。植物体内的酶系统能够催化活性氧的分解, 清除过多自由基, 维持平衡的稳定, 转基因拟南芥SOD和POD活性在胁迫后均明显高于WT, 表明在干旱胁迫过程中转基因株系抗氧化保护酶系统活性大幅度升高, 清除了转基因拟南芥植株内部大量的自由基[22], 有效对抗水分缺失对植株的伤害。这与在马铃薯(Solanum tuberosum)[23]、黑麦草(Loliumperenne)[24]等植物中进行的研究结果相似。由此说明, 过量表达ClCBF1基因的转基因拟南芥对抗干旱的过程中起到积极作用。
高盐胁迫导致植物细胞中的盐分逐渐累积, 产生渗透胁迫导致植物细胞失水, 产生生理干旱[25, 26], 严重损害植株抗氧化酶系统和代谢进程, 抑制植株的正常生长及发育。在本研究中, 随着盐浓度的增加, 拟南芥种子萌发率和根长整体下降, 转基因型种子的萌发率和根长明显高于WT, 这与前人对水稻(Oryza sativa)[27]的研究结果相似。植株细胞盐分的积累使之产生过量的活性氧, 发生过度的膜质过氧化反应, 生成有害物质MDA, 植株为了应对活性氧含量的上升, 自身的过氧化保护酶系统会随之发生变化。在转AtCBF3基因苹果(Malus pumila)组培苗的研究中, 转基因植株的相对电导率显著低于WT[28]。在本研究中盐处理后转基因拟南芥体内酶活性强于WT, 抗氧化酶清除了体内大量的自由基, 细胞膜破坏性较小, 使得MDA含量和相对电导率均低于WT, 这说明转入ClCBF1基因的拟南芥对盐胁迫耐受性有显著提高。
综上所述, 本研究通过将甘菊ClCBF1基因转入拟南芥, 发现ClCBF1基因提高了转基因株系对于干旱和盐胁迫的抗性, 表明其在植物响应盐和干旱胁迫过程中发挥一定作用, 这对后期将该基因转入其他植物进行进一步研究, 培育综合抗逆性强的新品系奠定基础。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|