第一作者:郭理想(1992-),男,河南南阳人,硕士,主要从事菌根生理生态学研究。E-mail:1549949086@qq.com共同第一作者:杨婕妤(1995-),女,广东顺德人,在读本科生,主要从事牧草逆境生物学研究。E-mail:vion1047@nwsuaf.edu.cn
为研究丛枝菌根真菌(AMF)对不同水分条件下紫花苜蓿( Medicago sativa)营养元素含量及生态化学计量学特征的影响,试验以紫花苜蓿阿尔冈金( M. sativa cv. Algonquin)为材料,通过温室盆栽的方法,在模拟干旱和正常供水两个水分梯度下,单接种丛枝菌根真菌AMF( Glomus constrictum,M)、单接种根瘤菌( Sinorhizobium meliloti,R)、双接种R和M(RM)以及不接种(CK),测定紫花苜蓿叶片和根系中碳(C)、氮(N)、磷(P)、钾(K)的含量并计算其生态化学计量学特征。结果显示,干旱胁迫降低了紫花苜蓿的生物量,抑制了叶片C、N、K和根系N、P和K的累积。M、R和RM处理均提高了干旱胁迫下紫花苜蓿的生物量,叶片C、N、P和K的含量,但却降低了根系N、P和K的含量。C/N对水分的响应较为不一致,但干旱胁迫提高了紫花苜蓿的叶片和根系的N/P和C/P。然而,M处理提高了干旱胁迫下紫花苜蓿叶片和根系的C/N、N/P和C/P。紫花苜蓿叶片和根系具有不同的代谢特征,所以其对AMF和水分具有不同的响应规律。此外,RM仅在对生物量和叶片N、P、K等方面具有较为明显的双接种协同增效的效益。本研究结果有助于进一步阐明共生体内C的消耗与N、P营养物质的转移之间的机制。
To evaluate the effect of arbuscular mycorrhizal fungi (AMF) on element contents and ecological stoichiometry of alfalfa ( Medicago sativa) under drought and well-watered conditions, alfalfa plants inoculated with AMF ( Glomus versiforme, M), rhizobia ( Sinorhizobium meliloti, R), dual inoculation (RM), or no inoculations (CK) were evaluated in a pot experiment under controlled conditions. Organic carbon (C), nitrogen (N), phosphorus (P), and potassium (K) of plant leaves and roots were measured and ecological stoichiometric characteristics were calculated. The results showed that drought reduced the biomass of alfalfa and decreased the contents of C, N, and K in leaves and N, P, and K in roots. The M, R, and RM treatments improved the biomass of alfalfa and the contents of C, N, P, and K in leaves, but decreased the contents of N, P, and K in roots under drought. The response of C/N to water stress was not consistent, but drought improved N/P and C/P of alfalfa in leaves and roots. However, the M treatment increased C/N, N/P, and C/P of alfalfa in leaves and roots under drought condition. With different metabolic characteristics, alfalfa leaves and roots exhibited varied responses to AMF and different water availabilities. Moreover, there was no general synergistic effect of dual inoculation with AMF and rhizobia on any parameter, except for the biomass and the contents of N, P, and K in leaves. All these results contribute to clarify the mechanism between consumption of C and transfer of N and P nutrition in symbiosis.
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是一类广泛分布的土壤微生物, 与超过80%的陆生植物根系形成共生关系[1, 2]。AMF能够增强宿主植物对磷(P)和氮(N)等营养元素的吸收, 作为回报宿主植物为AMF提供光合产物碳(C)[3]。紫花苜蓿(Medicago sativa)是我国栽培面积最大的豆科牧草之一, 有“ 牧草之王” 的美誉[4], 在水土流失较为严重的黄土高原地区, 紫花苜蓿不但是优良的家畜饲料, 同时由于发达的根系和较长的生长期, 其生态功能也尤为突出[5, 6]。根瘤菌(rhizobium, R)是紫花苜蓿的天然共生固氮细菌, 能够促进紫花苜蓿的生长, 增加土壤肥力[7]。因此, 在自然界中, 紫花苜蓿同时能够与AMF和根瘤菌形成共生体[8, 9, 10]。AMF与紫花苜蓿的共生能够增加紫花苜蓿P和N等营养物质的含量[9], 增强光合碳(C)同化的能力[10]。研究表明, AMF与豆科植物的共生能够通过延缓干旱胁迫下根瘤的衰老[11]提高宿主植物渗透调节能力[12]和活性氧清除能力[13]等, 进而提高宿主植物的抗逆性[14]。值得注意的是, AMF供给宿主植物P和N等营养物质的有益促生机制是以菌根消耗光合产物C为前提的, 因此, 掌握AMF对紫花苜蓿共生体中C、N和P等营养物质的影响规律, 有助于进一步阐明共生体内C的消耗与N、P营养物质的偶联关系。
生态化学计量学(ecological stoichiometry)是一门用于研究有机体和其生态环境中多个元素动态变化、循环和相互作用的学科[15]。近年来, 生态化学计量学被广泛应用在全球气候变化[15]、植物种群结构[16]、植物对环境的响应[17]及土壤限制性营养元素判定等[18]研究中。也有研究运用生态化学计量学的方法阐明了AMF共生体内的C、N和P的转移和分配机制[19], 评价了AMF侵染植物强于非侵染植物的竞争能力等[20]。但在不同水分条件下, 应用生态化学计量学的方法阐明AMF与紫花苜蓿体内C的同化与N、P营养物质吸收转移机制的研究还较少。此外, 植物的根系和叶片处在完全不同的生境中, 因此其理化属性是完全不一样的[21], 而紫花苜蓿叶片和根系中C、N和P等营养物质对AMF影响是否存在一致性也未见报道。因此, 本研究旨在研究AMF在干旱胁迫下对紫花苜蓿C、N和P等营养元素的积累及其生态化学计量学特征的影响规律, 明确叶片和根系对AMF和水分响应规律的异同, 同时比较AMF与根瘤菌的双接种与其单接种效益。本研究的开展将有助于进一步阐明AMF与紫花苜蓿共生体中C、N和P等营养物质的转移和交换机制, 为深入挖掘AMF对紫花苜蓿的促生作用提供科学依据。
试验选用紫花苜蓿(Medicago sativa)阿尔冈金(Algonquin)为供试植物。种子购于北京正道生态科技有限公司。供试AMF为地表球囊霉(Glomus versiforme), 由北京市农林科学院植物营养与资源研究所丛枝菌根真菌种质资源库(BGC)提供, 菌根接种体由扩繁植物紫花苜蓿根段、菌丝、孢子和沙土的混合物组成。供试根瘤菌(Sinorhizobium meliloti)菌株由中国科学院上海生命科学研究院。试验前用巴氏消毒液对温室、苗床和所用花盆进行消毒处理。所用土壤取自田间耕作层, 其主要营养成分如下:C(13.5 g· kg-1)、全N(1.26 g· kg-1)、N
试验设干旱35%± 5%田间持水量(D)和正常水分70%± 5%田间持水量(N)两个水分梯度。在每个水分梯度下设置, 单接种AMF(M)或R(R)、双接种AMF和R(RM)及不接菌(CK), 每个处理有4盆重复。按照Gao等[22]的方法, 移苗前向M和RM处理的土壤中每盆均匀混合AMF的混合物5 g(孢子数约60个· g-1)。在移栽后的前4周, 每周用注射器将15 mL的R接种液(菌数约1.0× 109 个· mL-1)分3次注射进幼苗根际土壤中。移栽6周后, 通过称重法每隔2 d用蒸馏水补充植物蒸腾失水, 使其处于不同的水分梯度下。处理4周后, 测定其叶片和根系中营养物质的含量。
从每个处理中随机选取5株植物, 根、茎和叶分离, 105 ℃杀青约30 min后, 在80 ℃的烘箱中烘干48 h后测定其根系和叶片的生物量。烘干的叶片和根系用球磨仪磨碎后用于测定其营养成分。用K2Cr2O7外加热法测定植物样品中有机碳的含量[23]。待测样品H2SO4-H2O2消煮后, 用AA3连续流动分析仪测定其全N和全K的含量[24]。消煮后的样品用钒钼黄比色法测定样品全P的含量[25]。
所有数据均用Excel处理, 并用IBM SPSS Statistics 19统计软件进行分析, 检验数据的正态性、齐性和独立性, 最小显著性差异法(LSD)对不同处理进行差异显著性分析。
CK处理下, 干旱胁迫显著降低了紫花苜蓿各器官的生物量(P< 0.05)。与CK相比, M、R和RM处理均显著提高了干旱处理下紫花苜蓿茎、叶生物量的积累(P< 0.05), 其中RM处理后, 紫花苜蓿的生物量最高; 而在正常水分条件下, M、R和RM处理均提高根系、茎和叶的干重, 其中RM处理下的生物量最大(P< 0.05)。在干旱与正常水分下, M、R和RM处理均显著提高紫花苜蓿的根冠比(P< 0.05)(表1)。
| 表1 AMF和根瘤菌对不同水分条件下紫花苜蓿单株生物量的影响 Table 1 Effect of AMF and rhizobium on the biomass per plant of alfalfa under different water conditions |
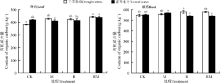
叶片和根系C含量分别为380~450和538~580 g· kg-1(图1)。CK处理下, 干旱胁迫显著降低了叶片的C含量(P< 0.05), 但对根系C含量没有显著影响(P> 0.05)。与CK相比, M、R和RM处理显著提高了干旱处理下叶片的C含量(P< 0.05), 而在根系中差异不显著(P> 0.05), 在正常水分条件下, 与CK相比, M和R处理下叶片C含量显著降低, 在根系中R和RM处理显著降低。
紫花苜蓿叶片和根系N含量分别为39.73~48.36和18.53~21.70 g· kg-1(图2)。CK处理下, 干旱胁迫显著降低了紫花苜蓿叶片和根系的N含量(P< 0.05)。M、R和RM处理均较CK提高了干旱处理下叶片的N含量, 且依次表现为RM> M> R。但在正常水分下, 仅有RM处理显著提高了其叶片的N含量(P< 0.05)。在干旱条件下, 与CK相比, M处理的根系N含量显著降低(P< 0.05)。
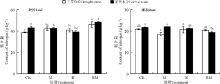
总体来看, 紫花苜蓿叶片和根系P含量分别为2.1~3.0 g· kg-1和根系1.0~2.0 g· kg-1(图3)。干旱胁迫显著降低了根系P含量(P< 0.05), 但对叶片P没有较为明显的影响。正常水分下, M处理显著提高了根系P的含量(P< 0.05), 但RM处理显著降低了根系P含量(P< 0.05); 在干旱胁迫下, 仅RM处理有提高根系P含量的趋势。
叶片和根系K含量分别为23.17~27.03和8.5~11.4 g· kg-1(图4)。CK处理下, 干旱胁迫显著降低了叶片和根系的K含量(P< 0.05), 且在根系较为明显。M、R处理均提高了干旱胁迫下紫花苜蓿叶片K的含量, 且在R处理下差异显著(P< 0.05); 而在正常水分条件下, R和RM处理对紫花苜蓿叶片K无显著影响(P> 0.05)。在正常水分条件下, M和RM处理降低了根系K的含量, 但在R处理下却显著提高了K的含量(P< 0.05); 而在干旱胁迫下, 仅M处理根系K含量显著低于CK(P< 0.05)。
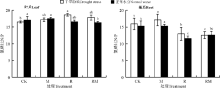
紫花苜蓿叶片和根系的C/N分别为9.1~10.1和25.4~30.5, 叶片C/N波动较根系相对较小(图5)。CK处理下, 干旱胁迫降低了叶片和根系C/N。在正常水分下, M、R和RM处理均降低了叶片C/N; 而在干旱胁迫下, M、R和RM处理均提高了叶片C/N, 只是差异不显著(P> 0.05)。根系和叶片C/N与对微生物接种和水分的响应规律较为相似。
叶片和根系N/P分别为16.3~18.6和11.6~17.1(图6)。CK处理下, 干旱胁迫显著降低了叶片N/P(P< 0.05), 但对根系N/P没有显著影响(P> 0.05)。与CK相比, M、R和RM处理均提高了干旱胁迫下叶片的N/P; 而在正常水分下, R和RM处理均降低了叶片的N/P。此外, R和RM处理均显著降低了两个水分处理下根系的N/P(P< 0.05)。
叶片和根系的C/P为148~180和298~480(图7)。CK处理下, 干旱胁迫显著降低了叶片的C/P, 但显著提高了根系的C/P(P< 0.05)。M、R和RM处理均提高了干旱处理下叶片和根系的C/P, 且R> M> RM; 而在正常水分下, 所有接种处理均降低了根系中的C/P。
干旱胁迫是限制牧草生产的重要因素之一。本研究中干旱胁迫降低了紫花苜蓿生物量及叶片C、N和K的含量。这可能是, 一方面干旱胁迫降低了紫花苜蓿叶片的膨压和气孔导度, 影响了叶片光合作用C的同化[25]; 另一方面, 干旱胁迫不但降低了土壤养分有效性[22], 而且还限制了生物固N的能力[26]。本研究中干旱胁迫虽然没有影响紫花苜蓿叶片P的含量, 但却显著降低了根系中P和K含量。这可能是土壤养分不足的情况下, 储藏在根系中的营养物质会被转运到地上[27]及干旱胁迫下营养元素利用效率提高[28]等原因造成的。
本研究中根瘤菌不但促进了两个水分处理下紫花苜蓿生物量的积累, 还提高了叶片N、根系C和K的含量, 这进一步说明根瘤菌作为紫花苜蓿的天然共生菌, 能够促进宿主植物的生长[7]。但本研究中紫花苜蓿的叶片和根系在不同水分条件下对根瘤菌的响应规律也不完全一致, 这可能是微生物与宿主植物之间的共生效益受到接种量、宿主植物生长期及土壤N和P营养物质有效性等因素的影响[29]。大量研究已证实, AMF能够通过延缓干旱胁迫下根瘤的衰老[11]、提高宿主植物渗透调节能力[12]和活性氧清除能力[13]等方式, 从而改善干旱胁迫下豆科植物的生长环境, 促进其C、N的代谢[9, 10], 这与本研究的结果AMF促进了干旱胁迫下紫花苜蓿体内的C、N含量的增加, 提高生物量的结果是一致的。此外, 本研究中AMF均显著提高了两个水分处理下紫花苜蓿叶片和根系中P元素的含量。AMF促进植物吸收P的机制已经被阐明, 即大量AMF的根外菌丝通过增加了根系吸收营养的面积、改变了根围的微生物组成、增强植物根际土壤中磷酸酶的活性等[30, 31]。研究表明, AMF菌丝能够增加共生植物对Ca和S等稳定元素或微量元素的吸收[32, 33], 但本研究并没有发现AMF提高紫花苜蓿对K元素吸收的证据, 这可能是由于物种及试验条件的差异所导致。
C、N和P是生物有机体内稳定存在的最主要的3种元素, C/N/P的变化在一定程度上决定了有机体的功能和特点[34]。本研究中, 干旱胁迫有增加紫花苜蓿叶片C/N的趋势, 这可能是干旱胁迫降低土壤N营养物质的释放及在植物根区的移动[35], 或者增加植物体内木质素含量等原因导致[36]。N/P反映了土壤养分有效性与植物对营养物质需要之间的动态平衡[37]。干旱胁迫降低了土壤营养物质有效性, 限制了植物对的营养物质的吸收[22, 26], 故在本研究中干旱胁迫总体上提高了紫花苜蓿的N/P。C/P反映了植物在吸收P的同时进行光合C同化的能力[38]。干旱胁迫抑制了地上部分的生长速率, 但植物倾向于将更多的资源分配到根系以维持根系的正常生长速率和较高的C/P[39]。因此, 在本研究中尽管干旱胁迫降低了叶片的C/P, 但增加了根系的C/P。研究表明, 植物组织有能力维持相对保守的生态化学计量学特征[40]。因此, 在本研究中干旱胁迫调节了紫花苜蓿叶片和根系C/N/P的变化, 但是在一定的范围内。
本研究, AMF与植物相互作用最终能够调节植物的生态化学计量学特征, 本研究结果与前人的研究结果[19, 41, 42]一致, 增加了宿主植物P和N含量, 提高植物的生长速度是菌根影响其生态化学计量学特征的最主要原因。此外, 本研究中, 紫花苜蓿叶片和根系生态化学计量学特征对水分和AMF的响应规律是不一致。这可能是由于植物的根系和叶片所处的生长环境的巨大差异, 其资源的获取, 分配、储藏能力是完全不一样的[21], 其次, 在营养物质限制的环境中, 植物营养物质在叶片和根系之间能够相互转移和再分配的[43]。
研究表明, 双接种对宿主植物的促进作用要超过单一接种, 这被认为是微生物之间相互兼容发生了协同增效作的效益[44, 45]。本研究中, AMF对生物量、叶片N、P、K有较为明显的双接种协同增效的效益。尽管深层的原因有待进一步的阐明, 但AMF和根瘤菌具有相同的形态学特征[46]和基因序列[47], 共生也具有相同的信号转导过程等, 这些都被认为是发生协同增效效益的重要机制之一。但本研究中, 双接种的协同增效的效益对所有的参数并不总是一致的, 本研究结果与近期一项对大豆(Glycine max)的研究结果是一致的[48]。相关研究表明, 土壤营养物质有效性、微生物之间的兼容性和宿主植物的生长期[49, 50]等都会影响协同增效的效果。
干旱胁迫是限制紫花苜蓿生物量、C同化、N和P营养元素吸收的重要的因素之一。AMF与紫花苜蓿的共生改善了宿主植物在干旱胁迫C的积累及N和P等资源的获取能力, 调节了宿主植物器官的生态化学计量学特征, 从而影响植物与菌根共生体内C、N和P等营养物质的循环等。由于紫花苜蓿的地上与地下部分所处的生态环境具有明显的差异, 所以叶片和根系对水分和AMF的响应规律较为不一致。此外, 双接种仅在一些方面发挥了协调增效的作用, 影响其协同增效的深层次的机制还有待于进一步阐明。
(责任编辑 苟燕妮)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|