第一作者:龙聪颖(1992-),女,四川广安人,在读硕士生,主要从事园林植物生理生态及栽培应用研究。E-mail:594613984@qq.com
采用盆栽试验研究不同浓度(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%)的NaCl、Na2SO4、Na2CO3对蓟( Cirsium japonicum)幼苗苗高、叶片相对含水量、丙二醛(MDA)、抗氧化酶(POD、SOD、CAT)以及渗透调节物质(可溶性糖、游离脯氨酸)的影响。结果表明,除0.1% NaCl处理蓟苗高和叶片相对含水量高于无盐胁迫(CK)外,其余处理均低于CK,且随盐浓度增加而降低,其中,0.3% NaCl、0.4% Na2SO4和0.1% Na2CO3处理下苗高依次为CK的62.15%、58.00%和45.77%,而0.5% Na2CO3处理幼苗死亡;随盐处理浓度增加和处理时间延长,叶片中丙二醛含量均呈上升趋势;POD、SOD、CAT活性随盐浓度、时间变化的趋势不尽一致,3种酶活性均出现了阈值,POD出现在0.3% NaCl、0.3% Na2SO4、0.4% Na2CO3胁迫5 d,SOD出现在0.3% NaCl处理3 d、0.5% Na2SO4处理1 d、0.4% Na2CO3处理3 d,CAT出现在0.3% NaCl、0.2% Na2SO4、0.1% Na2CO3胁迫3 d;相同处理时间下,随盐浓度的增加,除NaCl胁迫下游离脯氨酸(Pro)含量先增后减外,Na2SO4和Na2CO3胁迫下游离脯氨酸含量,以及3种盐胁迫下可溶性糖(SS)含量均逐渐增加。综上认为,蓟对NaCl、Na2SO4、Na2CO4这3种盐均具有一定的耐性,可以在低于0.3% NaCl、0.4% Na2SO4和0.1% Na2CO3条件下生存和生长。
The effects of three salt stresses (NaCl, Na2SO4, Na2CO3) at different concentrations (0.1%, 0.2%, 0.3%, 0.4%, 0.5%, and 0.6%) on seedling height, relative water content, malondialdehyde (MDA), antioxidase activity (POD, SOD, and CAT), and osmotic regulation substances (soluble sugar and free proline contents) in leaves of Cirsium japonicum were studied in pot experiments. The results showed that seedling heights and relative water contents were reduced compared to the control (CK) in all salt stress treatments except 0.1% NaCl treatment and that the effects increased with increasing salt concentrations. Seedling heights in the 0.3% NaCl, 0.4% Na2SO4, and 0.1% Na2CO3 treatments were 62.15%, 58.00%, and 45.77%, respectively, of the CK level; seedlings in the 0.5% Na2CO3 treatment died. Increasing salt concentrations and length of treatment caused an increase in MDA contents in leaves. The POD, SOD and CAT activities of leaves varied with changes in salt concentration and treatment time. A significant activity threshold was observed for POD on the fifth day of the 0.3% NaCl treatment, 0.3% Na2SO4 treatment, and 0.4% Na2CO3 treatment. Significant activity of SOD was first detected on the third day with 0.3% NaCl treatment, on the first day of 0.5% Na2SO4 treatment, and on the third day with 0.4% Na2CO3 treatment. Significant CAT activity was first observed on the third day with 0.3% NaCl treatment, 0.2% Na2SO4 treatment, and 0.1% Na2CO3 treatment. At the same process times, the proline contents increased at first and then decreased in the NaCl treatments; in the Na2SO4 and Na2CO3 treatments, the soluble sugar content increased gradually with the increase in salt concentration. In conclusion, C. japonicum shows some tolerance to NaCl, Na2SO4, and Na2CO3 stress, and can survive and grow under conditions of less than 0.3% NaCl, 0.4% Na2SO4, or 0.1% Na2CO3.
土地盐碱化是一个世界性难题, 全球盐碱地总面积达10亿hm2, 并以每年100万~150万hm2的速度增长[1]。我国盐渍土总面积约3 600万hm2, 占全国可利用土地面积的4.88%[2]。盐碱土是盐土和碱土的总称, 盐土主要指含氯化物或硫酸盐较高的盐渍化土壤, 而碱土是含碳酸盐或重碳酸盐的土壤。土壤是植物赖以生存的必要条件之一, 盐碱化土壤严重限制了植物的生存和生长。NaCl、Na2SO4等中性盐胁迫和Na2CO3、NaHCO3等碱性盐胁迫都能使植物光合器官遭到破坏, 叶绿素降解, 光合能力下降, 能耗增加, 生长量降低, 甚至导致死亡[3], 植物生态系统遭到严重破坏, 植物多样性大大降低, 环境恶化。而植被修复是改良、开发利用盐碱地的有效途径之一[4], 但盐碱地适生的植物种类比较少, 筛选、培育和应用新型耐盐性植物势在必行。已有研究表明, 白颖苔草(Carex rigescens)[5]、芒(Miscanthus sinensis)[6]、彩叶草(Coleus blumei)[7]等植物均可在一定范围的高浓度盐分土壤上表现出良好的耐受性。而已经研究和筛选的种类远远不足以满足盐碱地修复的需求。
野生植物种质资源是耐盐植物材料的重要来源, 在野生植物资源中筛选耐盐植物作为盐碱土植被修复的先锋物种, 可达到修复土壤、降低土壤盐碱化的目的, 从而为其他植物群落建立开辟条件。蓟(Cirsium japonicum)是菊科蓟属的多年生野生草本植物, 生长于土壤贫瘠的山坡、荒野, 具有较强的耐旱、耐寒、耐贫瘠等抗逆性, 在我国分布较广泛, 资源储量大, 其干燥地上部位具有凉血止血、散疲消肿的功效[8]。可作为矿坑再造、垃圾填埋场恢复、土壤污染治理的先锋植物, 是一种具有开发潜力的观赏花卉资源。目前对蓟的研究仅限于其药用价值[9, 10, 11]。但其耐盐性尚未见报道, 本研究探讨蓟在不同浓度NaCl、Na2SO4、Na2CO3胁迫下的生长及生理变化情况, 评价其耐盐性, 以期为蓟在盐碱地的修复和应用提供理论依据和数据参考。
2015年年底于都江堰虹口自然保护区采集蓟种子(注意在同一地点, 选取长势一致且健康的植株上进行采集), 净种后筛选出大小一致、颗粒饱满种子, 2016年3月上旬播种至盛有基质(V营养土∶ V田园土=1∶ 1)的塑料盆钵(上口径15 cm, 高15 cm)内, 置于四川农业大学科研基地内培养。待幼苗长至两片真叶时, 将其移栽于统一规格的花盆(口径25 cm, 高20 cm)中进行基质(V草炭土∶ V田园土∶ V珍珠岩=1∶ 1∶ 1)栽培, 每盆干土质量为1 kg, 每盆栽3株, 在条件一致的环境[大棚透光率为80%, 棚内温度为(25± 3)℃, 相对湿度为70%]下自然生长, 常规管理, 培养两周后, 选取生长旺盛、长势相近的蓟幼苗进行盐胁迫试验。
试验分NaCl、Na2SO4、Na2CO3胁迫3组, 均设 0.1%、0.2%、0.3%、0.4%、0.5%、0.6%共6个胁迫浓度(盐浓度为每1 kg干土壤中含有盐的质量分数), 每个浓度处理设5个重复, 每个重复1株苗, 以浇蒸馏水处理作为对照(CK)。采用一次性浇灌的方法将各浓度处理液浇入土壤基质中, 每盆浇盐水100 mL, 在花盆下放同样大小的托盘, 将流入托盘的盐溶液再次浇入土壤中, 反复几次, 直至不再流出, 以使土壤充分吸收盐溶液。
处理后的第1、3、5天, 于08:00观测幼苗生长状态并拍摄照片, 取中上部第3~5片叶进行各项指标的测定。对必须使用鲜样测定的指标立即进行试验, 其它叶片则用液氮冷冻于-70 ℃冰箱中保存。丙二醛、抗氧化酶系统以及渗透调节物质均称取洗净干燥叶片样品0.1 g进行测定。
1.2.1 形态指标 于盐胁迫处理后第5天08:00测定, 苗高为幼苗地径处至冠层最高处的垂直距离。
1.2.2 生理指标
相对含水量测定[12]:将取下的叶片用去离子水快速冲洗后用吸水纸吸干叶片表面水分, 称其鲜重后放入烘箱105 ℃杀青15 min, 80 ℃烘48 h至恒重, 称其干重, 计算相对含水量(%)。
相对含水量= [(鲜重-干重)/干重]× 100%。
丙二醛(MDA):采用硫代巴比妥酸(TBA)法[13]测定。
抗氧化酶系统:采用愈创木酚法[14]测定过氧化物酶(POD)活性; 参照NBT光化学还原法[15]测定超氧化物歧化酶(SOD)活性; 采用紫外吸收法[14]测定过氧化氢酶(CAT)活性。
渗透调节物质含量:采用酸性茚三酮法[16]测定游离脯氨酸(Pro)含量; 采用蒽酮显色法[16]测定可溶性糖(SS)含量;
采用Excel 2007进行数据处理和图表分析, 所有数据均为3次重复平均值。用SPSS 18.0统计软件进行单因素方差分析和显著性检验。
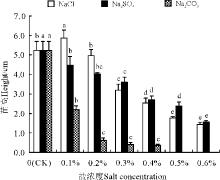
蓟幼苗苗高在NaCl处理下呈先升后降趋势, 峰值出现在浓度0.1%处理下, 苗高比CK高12%, 表现为低促高抑, 而Na2SO4和Na2CO3呈下降趋势(图1)。其中, 0.3% Na2CO3和0.6% NaCl处理下, 苗高大约为CK的62.15%和26.92%(P< 0.05); 0.4% Na2SO4和0.6% Na2SO4处理下分别为CK 的58.00%和30.77%, 而Na2CO3在0.1%时苗高为CK 的45.77%(P< 0.05), 0.5%浓度下幼苗全部死亡。
3种盐处理下, 处理时间相同, 随盐浓度增加幼苗叶片含水量均呈下降趋势, 处理浓度相同条件下, 随时间延长, 叶片含水量也呈下降趋势(表1)。NaCl处理除0.1%的1、5 d时0.2%的1 d叶片相对含水量与CK差异不显著(P> 0.05), 其余处理均显著低于CK(P< 0.05)。处理分别为1、3和5 d时, NaCl处理的最大降幅依次为CK的3.52%、8.13%和9.80%, Na2SO4处理的最大降幅依次为CK的1.01%、3.30%和4.84%, Na2CO3处理的最大降幅依次为CK的5.72%、12.08%和21.66%, 而Na2CO3处理5 d时浓度大于0.5%的幼苗全部死亡。3种盐在3个处理时间节点下, Na2CO3处理的最大降幅均最大, 其次为NaCl处理, Na2SO4处理下的最大降幅最小, 表明Na2CO3处理对蓟幼苗的胁迫作用最强, 长时间(≥ 5 d)、高浓度(> 0.5%)的Na2CO3胁迫将导致幼苗脱水死亡。
3种盐处理下, 处理时间相同, MDA含量随盐浓度增加呈逐渐上升趋势; 相同浓度的盐处理下, 随时间增加, MDA含量也呈上升趋势。除浓度小于0.1%的Na2SO4处理1和3 d的MDA含量与CK差异不显著(P> 0.05)外, 其余各处理均显著高于CK(P< 0.05)(表2)。3个处理时间节点下, 盐浓度为0.6%时, 除Na2CO3处理的幼苗死亡外, 其余处理的MDA含量增幅均达到最大, 与CK相比, NaCl处理的最大增幅依次为77.36%、75.93%和94.55%, Na2SO4处理的最大增幅依次为45.28%、72.22%和89.10%, Na2CO3处理的最大增幅依次为62.26%和135.19%。
处理时间相同时, 3种盐处理下的POD活性随盐浓度的变化趋势不尽相同, 而处理浓度相同时, 随时间增加, POD活性呈逐渐上升趋势。其中处理1、3和5 d, POD活性随NaCl浓度增加呈先升后降趋势, 3个时间节点下, 峰值分别出现在浓度0.5%、0.5%和0.3%时, 依次为CK的1.95、2.21、2.60倍; Na2SO4处理下, 处理1 d时, POD活性随浓度增加递增, 而处理3和5 d时则先升后降, 最大值分别在浓度0.6%、0.4%和0.3%时, 依次为CK的1.62、1.99和2.05倍; Na2CO3处理下, 处理1、3 d时, POD活性随浓度增加先急剧上升, 然后回落, 峰值在浓度0.4%、0.5%时, 分别为CK的1.70和2.92倍, 5 d时的POD活性则快速上升, 浓度0.4%时为CK的2.05倍。表明在到达峰值之前的处理下, POD均具有较高的活性氧清除能力。3种盐胁迫下, 处理5 d时, POD活性的最大增幅依次出现在NaCl和Na2SO4浓度为0.3%时, Na2CO3浓度为0.4%时, 表明上述处理为POD清除活性氧的阈值。
| 表1 3种盐胁迫下蓟叶片相对含水量(%) Table 1 The relative water contents(%) in Cirsium japonicum leaf under three types of salt-stress |
注:同行不同小写字母表示同一处理时间不同盐浓度处理下差异显著(P< 0.05); 同列不同大写字母表示同一盐浓度不同处理时间下差异显著(P< 0.05)。下表同。
Note: Different lowercase letters within the same row indicate significant differences at the same treatment time among different salt concentrations at the 0.05 level; And different capital letters within the same column indicate significant differences among the same salt concentration at different treatment days at the 0.05 level; similarly for the following tables.
| 表2 3种盐胁迫下蓟叶片MDA含量(mmol· g-1) Table 2 MDA content (mmol· g-1) in Cirsium japonicum leaf under three types of salt-stress |
| 表3 3种盐胁迫下蓟叶片中POD活性(U· g-1) Table 3 POD activity (U· g-1) of Cirsium japonicum seedlings under three types of salt-stress |
3种盐处理时间相同时, SOD活性随浓度的变化趋势不同; 处理浓度相同, SOD随处理时间的变化趋势也不尽相同(表4)。其中, NaCl处理1 d时, SOD活性随浓度增加而逐渐上升, 最大增幅是CK的3.50倍; 处理3、5 d时, SOD活性则随浓度增加先升后降, 峰值分别在浓度0.4%和0.3%时, 依次为CK的3.96和1.43倍。Na2SO4处理下, 处理1、3和5 d时, SOD活性均随浓度增加先升后降, 峰值均在浓度0.5%时, 依次为CK的7.42、4.01和2.44倍。Na2CO3处理下, 1 d时, SOD活性随浓度增加呈升-降-升趋势, 峰值首次出现在浓度0.3%时, 但0.6%时达最大值, 分别为CK的4.13、5.69倍; 处理3 d时, 随浓度增加, SOD活性先升后降, 在0.4%时出现峰值, 为CK的5.32倍。3种盐处理下, SOD活性的最大增幅分别出现在0.3% NaCl处理3 d时, 0.5% Na2SO4处理1 d时, 0.4% Na2CO3处理3 d时。表明低于上述处理时间和浓度范围内, SOD均有较强的活性氧清除能力。
相同处理时间下, 随盐浓度增加, CAT活性均呈先增加后降低趋势, 而处理浓度相同时, 大部分处理的CAT活性随时间增加也均呈先升后降趋势(表5)。处理1、3和5 d时, NaCl处理下CAT活性的峰值分别出现在浓度0.4%、0.3%、0.3%时, 最大值依次为CK的1.87、2.84和1.63倍; Na2SO4处理的峰值在浓度0.3%、0.2%和0.3%时, 最大值依次为CK的1.63、2.19和1.15倍, 而Na2CO3处理的峰值则分别出现在浓度0.5%、0.1%和0.1%时, 最大值依次为CK的3.00、4.43和1.87倍。3种盐处理的3个时间节点中, 处理3 d时CAT活性的增幅均最大, 且NaCl处理浓度小于0.3%、Na2SO4处理浓度小于0.2%、Na2CO3处理浓度小于0.1%条件下, CAT保持较高的活性。
2.5.1 可溶性糖 相同处理时间下, 随盐浓度增加, 可溶性糖含量均呈上升趋势; 处理浓度相同时, 可溶性糖含量随时间的变化不一致, 其中NaCl处理下, 浓度小于0.3%时, 随时间增加, 可溶性糖含量递增, 而浓度大于0.3%时则先增后降; Na2SO4处理下, 可溶性糖含量随处理时间增加逐渐上升, 而Na2CO3处理下, 则呈先增后降趋势(表6)。各处理叶片可溶性糖含量均显著高于CK(P< 0.05)。3个处理时间节点下, 除Na2CO3处理5 d外, 其余处理均在盐浓度为0.6%时达到最大值, NaCl处理的峰值依次比CK高42.58%、128.91%、90.38%, Na2SO4处理的依次比CK高的78.13%、90.63%、90.77%, 而Na2CO3处理依次比CK高50.00%、222.27%。3种盐胁迫下, 最大增幅依次出现在盐浓度0.6%时, 时间分别为NaCl处理3 d、Na2SO4处理5 d、Na2CO3处理3 d。
| 表4 3种盐胁迫下蓟叶片中SOD活性(U· g-1) Table 4 SOD activity(U· g-1) in Cirsium japonicum seedlings under three types of salt-stress |
| 表5 3种盐胁迫下蓟叶片中CAT活性(U· g-1) Table 5 CAT activity(U· g-1) of Cirsium japonicum seedlings under three types of salt-stress |
2.5.2 游离脯氨酸 相同时间处理下, 随NaCl浓度增加, 游离脯氨酸含量呈先增后减趋势, 而随Na2SO4和Na2CO3浓度增加呈增加趋势; 相同浓度时, 游离脯氨酸含量在NaCl、Na2SO4处理下随时间增加呈先增后减趋势, 在Na2CO3处理下则逐渐增加(表7)。3个处理时间节点中, NaCl处理分别在浓度为0.4%、0.5%、0.5%达到峰值, 增幅为CK的281.88%、546.90%、126.35%; Na2SO4处理下的峰值依次比CK高334.12%、315.58%、235.11%; Na2CO3处理下峰值依次比CK高192.79%、470.67%、457.93%。3种盐处理下, 游离脯氨酸含量最大增幅出现在0.5% NaCl处理3 d, 0.6% Na2SO4处理1 d, 0.6% Na2CO3处理3 d。表明在上述时间节点和浓度范围内, 蓟可通过游离脯氨酸含量增加来主动调节细胞的渗透势, 保持组织持水力, 超过上述范围, 调节能力降低。
| 表6 3种盐胁迫下蓟叶片可溶性糖(SS)含量(mg· g-1) Table 6 Soluble sugar contents(mg· g-1) in Cirsium japonicum leaf under three types of salt-stress |
| 表7 3种盐胁迫下蓟叶片游离脯氨酸(Pro)含量(mg· g-1) Table 7 Free proline contents(mg· g-1) in Cirsium japonicum leaf under three types of salt-stress |
盐分对个体形态发育具有显著的影响, 会抑制植物组织和器官的生长。而水分亏缺是植物遭受盐胁迫最直观的生理反应, 盐胁迫下植物组织的相对含水量是植物受盐胁迫程度的重要标志之一[17]。有研究[18, 19]发现, NaCl胁迫使幼苗生长受到抑制, 而本研究发现NaCl对蓟生长有低浓度(≤ 0.1%)促进、高浓度(> 0.1%)抑制作用, 其原因可能与浓度小于0.1% NaCl处理下叶片含水量略有增加有关, 而Na2SO4使叶片含水量降幅最小, Na2CO3降幅最大, 故Na2SO4处理下的抑制作用小于Na2CO3处理, 且Na2CO3胁迫在浓度0.1%时就表现出明显的抑制作用。
MDA是膜脂过氧化的产物, 对植物细胞具有明显的毒害作用, 其含量的高低和细胞质膜透性的变化可以反映细胞膜受伤害的程度[20, 21]。MDA浓度越大, 其受到的伤害越大。本研究显示, 盐胁迫下植物体内MDA含量增加均较为明显, 其中Na2CO3增幅最大, 膜质过氧化和脂质过氧化程度最严重, 在浓度0.5%处理5 d时即出现幼苗大量死亡。3种盐相比, Na2CO3作为一种碱性盐表现出强于NaCl和Na2SO4的胁迫作用, 而两种中性盐中, NaCl的胁迫效果强于Na2SO4, 这与徐静等[22]的研究结果一致, 其原因可能与蓟对Cl-比较敏感所致。
POD、SOD和CAT作为抗氧化酶系统的重要组成部分, 能有效清除植物体内的自由基和过氧化物, 是植物抵抗外界不良环境能力强弱的标志之一[23], 其中POD和SOD对保证质膜的完整性具有重要作用。有研究表明, 中低浓度、短时间的盐胁迫能诱导保护酶活性升高, 而高浓度、长时间盐胁迫则使抗氧化酶活性显著下降[22]。本研究表明, 3种盐胁迫下, 从酶活性的最大增幅来看, POD活性均出现在处理5 d时; 而SOD活性分别出现在NaCl处理3 d时、Na2SO4处理1 d时、Na2CO3处理3 d时; CAT活性出现在处理3 d时, 表明处理3 d之内, SOD和CAT在活性氧的清除中扮演着主要角色, 而处理5 d时则主要由POD承担活性氧的清除任务, 体现了3种酶协同作用清除活性氧的机制。同时, 3种酶活性均明显高于CK, 且SOD活性变化幅度(7.52倍)大于POD(2.92倍)和CAT(4.45倍), 表明盐处理激活了酶活性, 提高了活性氧的清除能力。从3种酶阈值出现的时间节点和盐浓度范围来看, POD出现在盐胁迫5 d, NaCl和Na2SO4浓度均为0.3%时, Na2CO3浓度0.4%时; SOD分别为0.3% NaCl处理3 d、0.5% Na2SO4处理1 d、0.4% Na2CO3处理3 d; CAT均出现在盐胁迫3 d时, 盐和浓度分别为0.3% NaCl、0.2% Na2SO4、0.1% Na2CO3。表明激活3种酶活性达到最大值所对应的盐浓度和时间不一致。这与前人研究认为酶活性存在一个阈值, 在一定的盐浓度和时间范围内, 酶活性得以提高和维持, 超过该浓度, 酶活性则下降[22, 24, 25]的结论一致。
渗透调节能力是植物适应环境、提高抗逆性的基础, 也是植物对环境胁迫的适应方式之一[7], 植物在遭遇高盐、干旱、低温等逆境胁迫时, 会迅速积累无机离子或合成有机溶质等渗透调节物质, 增强植物的防御能力, 从而减轻或避免伤害[26]。其中, 可溶性糖、脯氨酸等是植物体内重要的渗透调节剂[14]。脯氨酸作为细胞质的渗透压调节剂和防脱水剂, 可起到降低细胞渗透势, 提高组织持水力的作用, 可防止细胞脱水, 避免生理干旱, 植物受到盐渍环境胁迫时体内的游离脯氨酸含量会发生很大变化, 它的积累可能是植物受到胁迫的一种信号[27], 所以常将脯氨酸含量作为一种重要的植物抗盐碱性的指标[28]。可溶性糖也是一种重要的渗透调节物质, 它可以有效地提高细胞渗透浓度, 降低水势, 同时也是构成生物大分子的碳架和重要的能量来源[29]。本研究发现, 盐胁迫下, 游离脯氨酸与可溶性糖在蓟体内含量均高于CK, 游离脯氨酸的增幅明显大于可溶性糖, 说明盐胁迫下游离脯氨酸是蓟主要的渗透调节物质。NaCl胁迫下, 游离脯氨酸在盐浓度0.5%处理3 d时达到阈值, 而Na2SO4和Na2CO3胁迫下尚未出现阈值; 可溶性糖在3种盐胁迫下也未出现阈值。表明3种盐胁迫下, 蓟通过积累游离脯氨酸、可溶性糖来缓解盐害, 适应逆境。
综上所述, NaCl浓度≤ 0.3%胁迫下, 蓟幼苗生长抑制程度不大, 叶片水分亏缺不严重, 膜质过氧化不严重, 三大保护性酶POD、SOD和CAT活性均没超过阈值, 渗透调节物质可溶性糖和游离脯氨酸含量能大量积累, 保持细胞的正常结构和功能; Na2SO4浓度≤ 0.4%条件下, 尽管POD和CAT低于阈值, 但SOD尚未达到阈值水平, 叶片水分亏缺和膜质过氧化也不严重, 可溶性糖和游离脯氨酸含量也能快速积累, 幼苗苗高仍然不低于CK的50%; 而Na2CO3浓度≤ 0.1%时, 尽管POD和SOD低于阈值, CAT达到阈值, 叶片水分亏缺和膜质过氧化也不严重, 可溶性糖和游离脯氨酸含量也能快速积累, 但幼苗生长受到明显抑制, 苗高仅约为CK的45%, 可以认为蓟可以在低于0.3% NaCl、0.4% Na2SO4和0.1% Na2CO3条件下生存和生长。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| 30 |
|