第一作者:陈泰祥(1987-),男,甘肃陇西人,在读博士生,研究方向为禾草-内生真菌共生体。E-mail:chentxky@163.com
本研究对野大麦( Hordeum brevisubulatum)内生真菌( Epichloë bromicola)菌株 WBE1的生物学与生理学特性进行了研究。结果表明,内生真菌WBE1最适生长温度为22~25 ℃,4 ℃和35 ℃停止生长,最适生长pH为5.09~6.10的中性偏酸环境,对碳源的利用能力由强到弱依次为麦芽糖>D-山梨糖>甘露醇>蔗糖>乳糖>可溶性淀粉>葡萄糖>D-果糖,D-木糖抑制其生长;对可利用氮源的利用能力由强到弱依次为胰蛋白胨>牛肉膏>蛋白胨>酵母浸粉>L-甲硫氨酸>L-苯丙氨酸>亮氨酸,不能利用硝酸钾、脯氨酸、草酸铵,钼酸铵抑制其生长,光照对菌丝生长无影响,CMA、OMA、PSA和PDA是菌丝生长较适宜的培养基,在WBA培养基上40 d左右开始生长。菌株在PDA的前6周的生长速率呈增长趋势,第6周达最大值,第7周开始生长速率逐渐变小。
Biological and physiological characteristics of endophyte Epichloë bromicola strain WBE1 isolated from wild barley seeds were measured in a range of temperatures, pH, light, carbon source, nitrogen source and growth rate values. WBE1 was able to grow at temperate from 10 ℃ to 30 ℃ with the optimal temperature of 22~25 ℃ and stop growing at 4 ℃ and 35 ℃. The optimal pH for mycelial growth ranged 5.09 to 6.1. The ability of carbon source utilization decreased in the following order: maltose > D-sorbose > mannose > sucrose > lactose > starch > glucose. However, D-xylose inhibited the mycelial growth. The ability of nitrogen source utilization decreased in the following order: casein tryptone > beef extract > peptone > yeast > L-methionine > L-phenylalanine > leucine. However, potassium nitrate, praline and ammonium oxalate cannot be utilized by WBE1 and ammonium molybdate inhibited mycelial growth. Potato dextrose agar (PDA), oat meal agar (OMA), corn meal agar (CMA) and potato sugar agar (PSA) were optimal medium for WBE1. The mycelial growth rate on PDA reached maximum at the sixth week, then decreased gradually afterwards.
禾草内生真菌是指那些在宿主植物体内完成其全部或部分生活史但不引起宿主任何病症的一类真菌, 主要集中在麦角菌科(Clavicipitaceae)的Epichloë 属真菌, 广泛分布于天然草地和栽培草地的禾草体内, 主要定居在禾草的叶鞘、种子、花、茎、叶片和根等细胞间, 多数情况下, 在种子和叶鞘中的分布量最多, 叶片较少, 根中未检测到[1]。禾草内生真菌在“ 禾草内生真菌-宿主植物-草食动物” 生态系统中扮演着重要的角色, 一方面它能提高宿主植物的抗逆性, 另一方面, 它通过调控宿主植物的次生代谢产物— — 生物碱而导致家畜中毒, 是近年来国内外的研究热点之一[2, 3, 4]。近年来的研究方向主要集中在内生真菌提高宿主抗逆性的机制以及内生真菌种类多样性、遗传多样性, 宿主多样性等方面[3, 4, 5], 关于禾草内生真菌生物学特性的研究报道并不多见, 目前已报道生物学特性的内生真菌主要包括高羊茅(Festuca arundinacea)内生真菌Epichloë coenophiala[6-7]、鸭茅(Dactylis glomerata)内生真菌E. typhina[8]、披碱草(Elymus dahuricus)内生真菌 E. bromicola[9]、中华羊茅(Festuca sinensis)内生真菌 Epichloë sp.[1]以及醉马草(Achnatherum inebrians)内生真菌Epichloë gansuensis[10]和E. inebrians[11]等。
野大麦(Hordeum brevisubulatum)又名短芒大麦草、野黑麦, 是被子植物门(Angiospermae)单子叶植物纲 (Monocotyledoneae)禾本科(Gramineae)小麦族(Triticeae)大麦属(Hordeum)多年生优良牧草, 分布于欧洲、中亚、西伯利亚、伊朗、巴基斯坦等地。在我国主要分布于东北、内蒙古、陕西北部、宁夏、甘肃、青海、新疆、西藏等地。野大麦含有丰富的营养物质, 草质柔软, 适口性好, 对环境的适应能力较强, 且具有产量高、耐旱、耐盐碱的优良特性[12]。1991年首次在野大麦体内发现内生真菌[13], Moon等[14]于2004年将野大麦内生真菌鉴定为Neotyphodium属真菌, Leuchtmann等[15]于2014年将与禾草共生的香柱菌属的无性型Neotyphodium及其有性型Epichloë 属真菌进行了重新组合, 将Neotyphodium属真菌变为Epichloë 属。对于野大麦内生真菌共生体近年来开展了较多的研究, 如, 内生真菌提高了野大麦的抗虫性[16]以及野大麦种子在10、15 ℃低温和30 ℃高温胁迫以及干旱胁迫下的发芽率、幼苗生长速率等[17, 18], 同时内生真菌可促进野大麦在盐胁迫下的发芽率、株高、分蘖数和生物量[19]以及水淹环境下的存活和生长[20]。笔者所在课题组对野大麦内生真菌进行了分离鉴定, 将其鉴定为Epichloë bromicola (数据未发表), 但关于野大麦内生真菌的生物学特性至今仍未见报道。因此, 本研究对分离自甘肃张掖的野大麦内生真菌的生物学特性进行分析, 旨在为野大麦-内生真菌共生体的进一步研究奠定基础。
1.1.1 野大麦种子 于2014年9月采自兰州大学草地农业科技学院张掖临泽试验站, 采后置于封口塑料袋中, 保持新鲜状态, 带回实验室备用。
1.1.2 供试培养基 参照Li等[10]的方法, 制作马铃薯葡萄糖琼脂培养基(PDA)、马铃薯蔗糖琼脂培养基(PSA)、燕麦粉琼脂培养基(OMA)、玉米粉琼脂培养基(CMA)、查氏培养基(Czapek)、水琼脂培养基(WA)、野大麦草粉琼脂培养基(WBA)。
1.1.3 供试碳源 葡萄糖、可溶性淀粉、蔗糖、乳糖、甘露醇、麦芽糖、D-山梨糖、D-木糖、D-果糖共9种。
1.1.4 供试氮源 硝酸铵、草酸铵、酵母浸粉、蛋白胨、钼酸铵、硝酸钾、尿素、胰蛋白胨、L-甲硫氨酸、L-苯丙氨酸、脯氨酸、亮氨酸、牛肉膏共13种。
1.2.1 内生真菌的分离 将野大麦种子依次经75%酒精和5%次氯酸钠表面消毒各3 min, 再经无菌水漂洗3次, 用无菌滤纸吸干表面水分, 置于PDA培养基上于22 ℃黑暗培养, 培养2~3周后, 种子周围长出内生真菌菌落, 菌株经3次纯化后置于PDA斜面保存, 选取代表性菌株WBE1扩繁后, 备用。
1.2.2 温度对内生真菌生长的影响 用直径为0.4 cm的打孔器在菌落边缘打取菌饼, 接种于PDA平板中央, 分别置于4、10、15、20、25、30、35、40 ℃的恒温培养箱中黑暗条件下培养, 每处理6次重复, 30 d后十字交叉法测量菌落直径。
1.2.3 pH对内生真菌生长的影响 用1 mol· L-1的NaOH和HCl将PDA的pH分别调成4.29、5.09、6.10、7.19、8.10、9.34、10.13, 将0.4 cm的菌饼接种于上述不同pH的PDA平板中央, 每处理4次重复, 置于22 ℃的恒温培养箱中黑暗条件下培养, 30 d后测量菌落直径。测量方法同1.2.2, 下同。
1.2.4 不同碳源对内生真菌生长的影响 以查氏培养基为基础培养基, 以9种供试碳源等量替换(添加量均为3%)蔗糖配置成含不同碳源的培养基, 以不加碳源为对照, 将0.4 cm的菌饼接种于不同碳源平板中央, 每处理5次重复, 置于22 ℃的恒温培养箱中黑暗条件下培养, 30 d后测量菌落直径。
1.2.5 不同氮源对内生真菌生长的影响 以查氏培养基为基础培养基, 以13种供试氮源等量替换(添加量均为0.2%)硝酸钠配置成含不同氮源的培养基, 以不加氮源为对照, 将0.4 cm的菌饼接种于不同碳源平板中央, 每处理5次重复, 置于22 ℃的恒温培养箱中黑暗条件下培养, 30 d后测量菌落直径。
1.2.6 光照对内生真菌生长的影响 分别设置24 h光照、24 h黑暗、12 h光暗交替3种光照条件, 将接有0.4 cm菌饼的PDA培养基置于22 ℃的上述不同光照条件的恒温培养箱中, 每处理4次重复, 30 d后测量菌落直径。
1.2.7 不同培养基对内生真菌生长的影响 将直径0.4 cm的菌饼分别转入PDA、PSA、Czapek、CMA、OMA、WA 和WBA 7种不同培养基中, 置于22 ℃的恒温培养箱中黑暗条件下培养, 每种培养基7次重复, 35 d后测定菌落直径。
1.2.8 菌落生长速率测定 将接有菌饼的PDA培养基置于22 ℃的恒温培养箱中黑暗条件下培养, 每7 d测量一次菌落直径, 连续测量8周, 计算菌落生长速率。
1.2.9 试验数据统计分析 试验所得数据, 采用Excel软件作图, IBM SPSS Statistics 19.0软件进行差异显著性分析(Duncan法)。
培养约3周后, 野大麦种子周围长出真菌菌落, 气生菌丝体形成白色的棉状菌落, 致密, 菌落周围有一圈淡褐色的色素, 无味。菌落背面呈褐色, 从中央到边缘色素圈还逐渐变淡(图1)。
野大麦内生真菌WBE1在10~30 ℃范围类均能生长。4 ℃和35 ℃条件下不能生长, 接菌30 d后菌落直径仍为0.4 cm。菌株在22~25 ℃条件下生长最快, 30 d后菌落直径分别为3.31和3.28 cm, 20~25 ℃条件下菌落直径显著大于其它温度下的菌落直径(P< 0.05), 菌落直径由大到小的温度条件依次为22 ℃> 25 ℃> 20 ℃> 30 ℃> 15 ℃> 10 ℃(图2)。表明该菌最适宜生长温度为22 ℃。
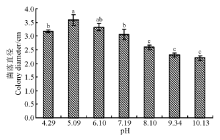
该菌株在pH 4.29~10.13条件下生长良好, 培养30 d后菌落直径大于2.2 cm。pH 5.09~6.1条件下生长较快, 30 d后菌落直径为3.59和3.33 cm。pH中性偏酸的菌落直径显著大于偏碱性的(P< 0.05), 可见, 野大麦内生真菌对酸碱度的适应范围广且偏好酸性的培养条件, 生长最适pH 为5.09(图3)。
供试的9种碳源中除D-木糖外的其它碳化物的菌落直径均显著大于对照菌落的直径(P< 0.05), 说明D-木糖显著抑制该菌的生长(P< 0.05)。该菌株能较好地利用麦芽糖、D-山梨糖、甘露醇、蔗糖和乳糖, 其次为可溶性淀粉、葡萄糖和D-果糖。可见, 该菌对多种单糖、双糖和多糖都能利用, 对碳源的需求不严格。供试的9种碳化物中, 麦芽糖为WBE1生长的最佳碳源。
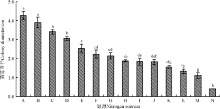
该内生真菌对供试的13种氮源的利用能力存在较大差异, 对胰蛋白胨和牛肉膏的利用能力最强(图5), 显著高于其它供试氮源(P< 0.05), 其次为蛋白胨、酵母浸粉和L-甲硫氨酸, 对L-苯丙氨酸、亮氨酸、硝酸钾、脯氨酸和草酸铵的利用能力较弱, 但与对照差异不显著(P> 0.05), 而硝酸铵、尿素和钼酸铵对该菌株有一定的抑制作用, 尤其是钼酸铵培养基, 培养30 d后菌落直径仍为0.4 cm。
培养30 d后, 不同光照处理条件下的菌落直径基本一致, 差异不显著(P> 0.05)(表1)。说明该菌株对光照不敏感, 在黑暗和光照条件下均可正常生长。
| 表1 光照对WBE1菌丝生长的影响 Table 1 Effect of illumination on mycelial growth of WBE1 |
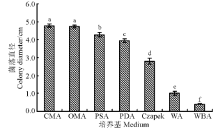
培养35 d后, 供试的7种培养基的菌落直径依次为CMA> OMA> PSA> PDA> Czapek> WA> WBA(图6), 其中CMA和OMA的菌落直径显著大于其它培养基的菌落直径(P< 0.05), 二者间差异不显著(P> 0.05), 野大麦草粉培养基WBA的菌饼还未开始生长, 菌落直径仍为0.4 cm。CMA、OMA、PSA和PDA是菌株WBE1菌丝生长的适宜培养基。
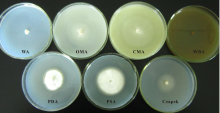
内生菌WBE1在22 ℃黑暗条件下培养30 d, 不同培养基的菌落形态存在一定的差别(图7)。WA培养基的气生菌丝呈棉状, 较茂密, 菌背淡黄色。OMA的气生菌丝体形成白色的棉状菌落, 菌丝稀疏, 肉眼观测不明显, 菌落周围有无色生长圈, 菌背呈白色。CMA的气生菌丝体稀疏, 肉眼观测不明显, 菌落周围有较明显的无色生长圈。PSA和PDA菌落形态相似, 气生菌丝体形成白色的棉状菌落, 致密, 菌落周围有一圈淡褐色的生长圈, 菌落背面中央褐色到深褐色, 周围的生长圈呈淡褐色。Czapek气生菌丝成棉状, 中等茂密, 表面淡褐色, 菌背无色。菌株WBE1在WBA上生长缓慢, 培养40 d左右才开始生长, 培养至50 d时直径为1.18 cm, 气生菌丝体呈白色, 致密。
内生真菌WBE1在PDA上生长良好, 接菌后表现出良好的生长趋势, 22 ℃黑暗条件连续培养1周后平均菌落直径为0.7 cm, 连续培养8周后为6.34 cm(图8)。前6周的周平均生长速率呈上升趋势, 第1周平均周生长速率为3 mm· 周-1, 从第4周开始, 增长趋势下降, 第4周比第3周仅增长了0.38 mm, 第6周达最大值, 周平均生长速率为11.13 mm· 周-1, 此后生长速率呈下降趋势, 第7周为7 mm· 周-1, 第8周为6.33 mm· 周-1。可见, PDA培养基适于野大麦内生真菌的分离和菌落生长培养。
明确内生真菌生物学特性可对内生真菌的传播、侵染机制及其在宿主体内的定殖等方面的研究提供理论依据。本研究表明, 野大麦内生真菌WBE1最适生长温度为22~25 ℃, 4 ℃和35 ℃停止生长, 最适生长pH为5.09~6.10的中性偏酸环境, 菌丝生长的最适碳源为麦芽糖, D-木糖抑制其生长, 最适氮源为胰蛋白胨和牛肉膏, 钼酸铵抑制其生长, 光照对菌丝生长无影响, CMA、OMA、PSA和PDA是菌丝生长较适宜的培养基, 在WBA培养基上40 d左右才开始生长。菌株在PDA的前6周的生长速率呈增长趋势, 第6周达最大值, 第7周开始生长速率逐渐变小。
野大麦内生真菌WBE1在低于4 ℃和超过35 ℃的环境中不能生长, 说明此真菌适宜在相对较低的温度下生长, 同时WBE1对酸碱度的适应能力较强, 在pH 4.29~10.13范围内均能良好生长, 这与其宿主植物是耐盐性强的物种相吻合[12]。WBE1可在无氮源的Czapek培养基生长, 且在缺氮的培养基中的生长甚至超过了在硝酸钾、脯氨酸、草酸铵和硝酸铵中的生长, 说明该菌株有高效的氮代谢途径。在无碳源的培养基上也可缓慢生长, 说明该菌株有较发达的碳代谢途径。而D-木糖抑制其生长, 可考虑用作增效剂来提高化学药剂对野大麦内生真菌的抑制作用, 建立不含内生真菌种群。
已报道的禾草内生真菌如E. festucae、E. coenophiala、E. typhina、Epichloë typhina subsp. poae、E. gansuensis以及中华羊茅内生菌Epichloë sp.的最适生长温度均为25 ℃[1, 6, 7, 8, 9, 10], 与本研究WBE1的最适温22~25 ℃基本相似。而营养指标如碳氮源以及最适生长的pH和最适培养基等指标在一定程度上存在差异, 如, 羊茅香柱菌 E. festucae的最适pH 为5, 碳源和氮源分别为乳糖和酪蛋白[10]; 醉马草内生菌E. gansuensis的最适pH为7, 最适碳、氮源为纤维素酶和酵母膏[10]; 中华羊茅内生真菌Epichloë sp.的最适pH 为9, 最适碳、氮源为甘露醇和酵母浸液[1]; 高羊茅内生菌E. coenophiala的最适pH为9, 最适碳、氮源分别为纤维素酶和L-脯氨酸[10]。也有报道认为E. coenophiala可利用一些己糖和二糖做为碳源, 但多糖和戊糖则不能被利用[6, 7], 所以同一种内生真菌可能因宿主不同、地域不同, 其生物学特性仍有差异。
不同种的禾草内生真菌在生物学特性方面也有一定相似性, 如大多数Epichloë 属真菌菌丝生长的最适培养基为PDA, 木糖不仅能抑制野大麦内生真菌的生长, 同时不能被E. coenophiala、E. chisosa、E. typhina等利用, 而且很难被E. gansuensis和E. coenophiala所利用[21, 22]。
硝酸钾、脯氨酸、草酸铵、硝酸铵等氮源不能被WBE1利用是否是因为真菌体内缺少相关分解酶等, 原因还有待于进一步研究。尿素、钼酸铵和D-木糖抑制WBE1的生长是否是因为离子毒害作用或缺少相关代谢途径等, 原因也有待于进一步的探讨。
禾草内生真菌分离过程中表面灭菌试剂、灭菌时间和分离培养条件是非常关键的因素[23], 表面灭菌掌握不当, 会造成表面的非目标真菌混入或直接将内生真菌杀死, 因此, 很有必要设计合适的表面灭菌方法和分离培养方法, 以保证内生真菌的分离效果。从分离结果来看, 本研究选用的分离方法“ 75%酒精-5%次氯酸钠表面消毒各3 min, 再经无菌水漂洗3次, 用无菌滤纸吸干表面水分” 是分离野大麦种子中内生真菌较合理的方法。
由于内生真菌的生长很慢, 需要培养很长时间菌落才能出现, 那时培养基可能已干, 因此很有必要掌握内生真菌生长的最佳条件, 本研究摸索了野大麦内生真菌生长的最佳条件, 为此菌的进一步研究提供了理论依据。目前, 对禾草内生真菌在体外的研究主要依赖于培养基, 用哪些培养基才能最大限度地反映内生真菌在宿主组织中的真实状态, 尚需探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|