第一作者:潘佳(1991-),女,甘肃民勤人,在读硕士生,主要从事作物栽培与耕作研究。E-mail:panj14@lzu.edu.cn
本研究结合温室盆栽和大田试验,研究了接种不同根瘤菌菌株对甘农3号( Medicago sativa cv. Gannong No.3)和陇东苜蓿( M. sativa cv. Longdong)幼苗生长及结瘤特性的影响,并进一步分析了接种根瘤菌后陇东苜蓿的光合特性及其生物量构成因素的变化。结果表明,盆栽条件下,甘农3号接种17767菌株后,生物量、株高、分枝数和叶数分别增长了102%、100%、17%和18%;陇东苜蓿接种17625菌株后,生物量、株高、分枝数和叶数分别增了187%、48%、80%和47%。而在大田条件下,甘农3号接种17650菌株后,生物量和株高分别增长了21%和13%;陇东苜蓿接种17574菌株后,生物量和株高分别增长了348%和70%。盆栽条件下,相比未接种处理,接种6-3、17537、129、17670、17582、17578、17650菌株均不同程度地提高了陇东苜蓿的水分利用效率,仅接种17578、17582菌株提高了其光合速率。综合盆栽与田间试验,与甘农3号最佳共生匹配的根瘤菌菌株为B2;而与陇东苜蓿最佳共生匹配的根瘤菌菌株为17650。
Using a combination of greenhouse pot and field experiments, this study determined the effect of inoculation with different rhizobial strains on seedling growth and nodulation capacity of two cultivars of Medicago sativa. Further, seedling photosynthetic characteristics and biomass components of M. sativa cv. Longdong were analyzed. The results showed that seedling biomass, plant height, number of branches and number of leaves of M. sativa cv. Gannong No.3 increased by 102%, 100%, 17% and 102%, respectively, after inoculation with 17767 strains in greenhouse; while Longdong inoculated with 17625 strains increased seedling biomass, plant height, number of branches and number of leaves by 187%, 48%, 80% and 47%, respectively. In the field condition, seedling biomass and plant height of M. sativa cv. Gannong No.3 was increased by 21% and 13%, respectively after inoculation with 17650 strains; while Longdong cultivar inoculated 17574 strains increased seedling biomass and plant height by 348% and 70%, respectively. Inoculated 6-3, 17537, 129, 17670, 17582, 17578 and 17650 strains treatments increased plant water use efficiency to some extent in Longdong cultivar, whereas seedling photosynthetic rate was increased only by inoculating 17578 and 17582 strains. Based on their performance in the greenhouse and field condition, the optimal symbiotic rhizobial strains with M. sativa cv. Gannong No.3 and M. sativa cv. Longdong was B2 and 17650, respectively.
根瘤菌是一类广泛分布于土壤中的革兰氏阴性细菌, 它能侵染豆科植物根部形成根瘤, 通过生物固氮, 为植物提供氮素营养[1]。根瘤菌固氮不仅能提高豆科植物产量、改善品质, 而且能提高土壤肥力、改善土壤结构, 还可以为后茬作物提供部分氮素营养[2, 3]。根瘤菌结瘤是一个竞争的过程, 受许多因素的影响, 如土壤条件、土著根瘤菌数、植物种、品种以及根瘤菌剂等[4]。如对马占相思(Acacia mangium)[5]、厚荚相思(A. crassicarpa)[6]、热研5号柱花草(Stylosanthes guianensis ‘ Reyan No.5’ )[7]等的研究表明, 不同的根瘤菌与豆科植物的共生固氮能力存在着较大的差异[8]。因此, 对于在不同区域种植的不同豆科植物种或品种, 开展其与根瘤菌共生固氮优良组合的筛选研究, 提高根瘤菌-植物共生体的固氮效率一直是生物固氮研究领域中的热点及重点工作[2]。
紫花苜蓿(Medicago sativa)是世界上栽培最早、分布最广的多年生豆科牧草。在我国西北地区特别是黄土高原雨养农业区, 苜蓿栽培普遍存在管理粗放、单产不高、草品质低等问题, 这在一定程度上不仅限制了苜蓿的栽培利用, 也影响了农牧民创收。国内外发展苜蓿的经验表明, 紫花苜蓿接种根瘤菌后, 其产量与品质都有一定程度的改善[8, 9, 10]。基于此, 为苜蓿主产区当家品种筛选高效根瘤菌可能是改善苜蓿产量和品质的一个重要途径。如对中苜1号接种根瘤菌ACCC17544, 不仅能增强其共生固氮效果, 还能提高干草产量并增加粗蛋白含量[1]; 对盛世苜蓿品种接种菌株Y6-1-1、BB2-2-1-1、WZ-6-2-2, 可以显著提高其植株的干重、叶绿素含量、全氮量和产量[11]; 对Vector紫花苜蓿品种接种CCBAU30138、CCBAUN210及CCBAUN96077根瘤菌能显著提高其干草产量和单位面积蛋白质产量[12]。但有关根瘤菌接种对黄土高原雨养区主要栽培品种如陇东苜蓿等的影响, 尚未见相关报道。考虑到苜蓿品种以及根瘤菌来源对于其共生体固氮效率的影响, 开展该区域苜蓿品种与根瘤菌的筛选工作对于生产实践具有重要意义。基于此, 本研究以甘农3号(M. sativa cv. Gannong No.3)和陇东苜蓿(M. sativa cv. Longdong)为试验材料, 评价其接种根瘤菌菌株在温室与田间条件下的表现, 进而获得不同品种与根瘤菌菌株的优良组合, 以期为黄土高原区苜蓿高效栽培提供理论依据。
1.1.1 供试种子 甘农3号与陇东苜蓿种子由甘肃农业大学草业学院提供, 试验前室温条件下贮存。
1.1.2 供试菌株 由中国农业科学院北京畜牧兽医研究所杨青川提供, 共计30株, 具体信息见康俊梅等[1]及表1。
| 表1 供试菌株 Table 1 The source of different strains |
1.2.1 菌株培养 将供试菌株接种至YMA固体培养基上活化, 然后转入YMA液体培养基的50 mL离心管内, 震荡(转速200 r· min-1, 28 ℃)48 h, 培养(28 ℃)至对数期, 当菌液OD600 nm值大于0.5时用于接种。
YMA培养基的化学组成(g· L-1):NaCl 0.1 g、K2HPO4 0.5 g、CaCO3 3 g、MgSO4· H2O 0.2 g、甘露醇10 g、酵母粉1.0 g、蒸馏水1 000 mL。
1.2.2 接种方法 种子经10%的H2O2浸泡10 min, 而后以70%乙醇浸泡3~5 min, 然后用蒸馏水冲洗7~8次。转移至灭菌的培养皿中, 先在10 ℃条件下吸水24 h, 再置于20 ℃条件下避光催芽12 h。
将胚根长为2~3 mm的种子置于根瘤菌液中浸泡5 min, 而后播种于沙质土壤中, 播种后将15 mL根瘤菌液倒入根部。不接种处理倒入15 mL灭菌(121 ℃, 90 min)的根瘤菌液。
1.3.1 育苗 盆栽试验在兰州大学榆中校区温室中进行, 培养室温度为(25± 3)℃/(10± 3)℃(昼/夜)。花盆直径14 cm、深度12 cm, 每盆装入水洗砂(121 ℃灭菌2 h)约1.5 kg。甘农3号、陇东苜蓿分别用30种不同根瘤菌进行接种处理(见1.2.2), 以不接种根瘤菌作为空白对照(CK), 每处理重复3次。每盆播种5株, 每2 d浇水一次, 以确保供水充足。
出苗两周后开始间苗, 每盆留3株长势相似的植株。间苗后, 分别用1/8、1/4、1/2以及全营养液各浇一周, 每周3次, 每次120 mL。营养液组成(g· L-1):K2HPO4 0.22 g、KCl 1.55 g、MgSO4 1.225 g、CaCl2 2.15 g。其它微量元素含量与Hoagland营养液完全一致。溶液pH用KOH和HCl调至(7.0± 0.1)。
1.3.2 形态学指标测定 待植物长到第9周时收获。收获前测定所有植株的茎粗、叶子数、分枝数和株高。收获时以清水冲洗根部, 分别测定每株植物的有效根瘤数(以粉红色为标准)及其植株生物量。为了进一步分析陇东苜蓿的生物量构成因素, 选取陇东苜蓿长势相对较好的8个处理(包含对照), 测定其单株总叶面积, 比叶面积[13], 根、茎、叶生物量及光合特性等。
比叶面积=叶片面积/叶片干重。
采用烘干法测定生物量。利用Winseedle扫描仪(J221A, INDONESIA)测定叶面积。光合测定时, 选取植株自上而下完全展开的第3片叶, 使用Li-Cor 6400光合仪(Li-Cor, NE, USA)进行测定, 每处理测定3株, 每株测定一片叶。为避免自然光源光照强度变化对植物光合的影响, 光合测定时采用光合仪自带的人工光源, 光强1 000 μ mol· (m2· s)-1。最后计算水分利用效率[14], 水分利用效率=净光合速率/蒸腾速率。
本研究在兰州大学榆中校区网室中进行。试验之前先将PVC管(直径15 cm, 深度30 cm, 底端以尼龙网包裹)埋入土中, 并将试验田的土壤在121 ℃条件下灭菌2 h后重新填回PVC管。甘农3号、陇东苜蓿种子分别用29种(除17767外)根瘤菌进行接种处理(见1.2.2), 以不接种根瘤菌作为空白对照(CK), 3个重复。幼苗生长期间, 每周浇水两次。
待植物长到第9周时收获。收获时先用清水将根部冲洗干净, 再分别测定每株植物的有效根瘤数(以粉红色为标准)、苗长。最后将整个植株在烘箱内(65 ℃)烘24 h至恒重, 测定其生物量。
数据分析用SPSS 19.0统计软件进行相关性分析, 采用One-way ANOVA进行单因素方差分析, LSD法进行多重比较, 绘图用Excel 2003。
2.1.1 接种根瘤菌对甘农3号、陇东苜蓿生长特性的影响 因菌株与品种不同, 相比于未接种处理, 接种根瘤菌会增加、降低或者不影响紫花苜蓿幼苗生物量、株高、分枝数以及叶子数。
对于甘农3号, 15个接种处理显著增加了其幼苗的单株生物量(P< 0.05), 其中接种17592、174、17767菌株增幅较大, 分别为67%、80%、102%(图1); 与生物量相似, 多数接种处理显著提高了其株高, 其中接种17578、174、17592、17767菌株增幅较大, 为69%~100%(图2); 就分枝数而言, 接种6-3、143、17688、17767菌株的分枝数显著高于对照(P< 0.05), 增幅均为17%左右(图3); 接种174、17767、17672菌株显著提高了植株的叶子数(P< 0.05), 增幅分别为18%、18%、35%(图4)。
 | 图1 温室盆栽条件下根瘤菌接种对甘农3号、陇东苜蓿生物量影响Fig.1 Effect of inoculation with different rhizobium strains on seedling biomass of Gannong No.3 and Longdong in greenhouse |
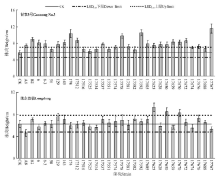 | 图2 温室盆栽条件下根瘤菌接种对甘农3号、陇东苜蓿株高的影响Fig.2 Effect of inoculation with different rhizobium strains on plant height of Gannong No.3 and Longdong in greenhouse |
 | 图3 温室盆栽条件下根瘤菌接种对甘农3号、陇东苜蓿分枝数影响Fig.3 Effect of inoculation with different rhizobium strains on number of branches of Gannong No.3 and Longdong in greenhouse |
 | 图4 温室盆栽条件下根瘤菌接种对甘农3号、陇东苜蓿叶子数的影响Fig.4 Effect of inoculation with different rhizobium strains on number of leaves of Gannong No.3 and Longdong in greenhouse |
对于陇东苜蓿, 13个接种处理显著增加了其幼苗的单株生物量(P< 0.05), 其中接种17512、17592、17625菌株增幅较大, 分别为87%、133%、187%(图1); 与生物量相似, 多数接种处理提高其株高, 其中接种17670、17650、17625菌株株高增幅较大, 为32%~48%, 与对照相比存在显著差异(P< 0.05)(图2); 从分枝数来看, 接种17605、17625菌株显著提高其分枝数(P< 0.05), 增幅分别为40%、80%(图3); 从叶子数来看, 接种17650、17625、17551菌株后其叶子数显著增加(P< 0.05), 增幅分别为40%、47%、53%(图4)。
在盆栽试验中, 通过对生物量、株高、分枝数、叶子数的分析, 初步得出甘农3号接种174、17767、17592、B2菌株效果较好, 陇东苜蓿接种17650、17625、17592、17512菌株效果较好。
2.1.2 接种根瘤菌对甘农3号、陇东苜蓿有效根瘤数的影响 除菌株50、17676、129、174等8个接种处理显著提高了甘农3号的有效根瘤数外(P< 0.05), 多数接种处理对甘农3号的有效根瘤菌数无显著影响(P> 0.05)(图5); 与此相反, 陇东苜蓿接种根瘤菌后, 绝大部分结瘤能力显著提高, 其中接种17525、17670、129、17578和17672菌株后结瘤数增加幅度较大, 增幅分别为167%、167%、200%、200%和200%(图5)。
2.2.1 接种根瘤菌对甘农3号、陇东苜蓿生长特性的影响 甘农3号接种17650、17581、B2菌株后, 单株生物量相比对照增加幅度较大, 增幅分别为21%、43%和44%(图6); 接种17650、17512、17581菌株后, 株高增幅较大, 分别为13%、26%、58%, 但只有接种17581菌株处理株高显著高于对照(P< 0.05)(图7)。
 | 图6 大田条件下根瘤菌接种对甘农3号和陇东苜蓿单株生物量的影响Fig.6 Effect of inoculation with different rhizobium strains on seedling biomass per plant of Gannong No.3 and. Longdong in field |
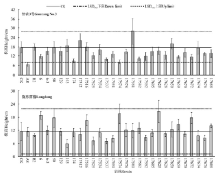 | 图7 大田条件下根瘤菌接种对甘农3号和陇东苜蓿株高的影响Fig.7 Effect of inoculation with different rhizobium strains on plant height of Gannong No.3 and. Longdong in field |
与甘农3号不同, 陇东苜蓿接种根瘤菌后, 有11个接种处理显著增加了其幼苗单株生物量(P< 0.05), 其中接种17672、17659、6、17574菌株增幅较大, 增幅分别为274%、287%、333%、348%(图6); 从株高看, 部分株高增加, 但没有显著差异(P> 0.05), 增加幅度较大的是6、17574、17625, 分别增加了64%、70%、80%(图7)。
在田间试验中, 通过对生物量、株高的分析, 初步得出甘农3号接种17650、17581、B2菌株效果较好, 陇东苜蓿接种17650、6、17574菌株效果较好。
2.2.2 接种根瘤菌对甘农3号、陇东苜蓿有效根瘤数的影响 对于甘农3号, 8个接种处理显著增加了其有效根瘤数(P< 0.05), 其中接种17581、B2、17628菌株增幅较大, 分别为105%、132%、150%(图8); 对于陇东苜蓿, 13个接种处理显著增加了其有效根瘤数(P< 0.05), 其中接种17582、17688、17574菌株增幅较大, 增幅分别为344%、356%、600%(图8)。
2.3.1 生物量构成因素 相比对照, 7种根瘤菌接种处理均不同程度地提高了陇东苜蓿的幼苗生物量。与生物量相似, 接种根瘤菌后根生物量均呈增加趋势, 其中接种17670菌株增加幅度最大, 达200%。与以上不同的是, 接种根瘤菌后, 茎粗、茎叶比、地上/地下生物量、比叶面积均呈现下降趋势, 其中对照的地上/地下生物量显著高于所有接种处理(P< 0.05)。此外, 除接种菌株17537外, 其它接种处理的叶生物量均高于对照的。茎生物量则因接种菌株不同相比对照表现出较大变异(表2)。
| 表2 接种条件下陇东苜蓿单株生物量构成因素 Table 2 Seedling biomass components of Medicago sativa cv. Longdong under inoculation |
2.3.2 光合特性 接种17582、17578菌株显著提高了陇东苜蓿幼苗的净光合速率, 较对照增幅分别为22%、31%(P< 0.05), 其它接种处理对光合速率无显著作用(图9)。接种根瘤菌对幼苗蒸腾速率与气孔导度的影响存在较大变异, 其中接种17582菌株显著提高其蒸腾速率与气孔导度(P< 0.05), 而接种6-3、17578、17670、17650菌株则显著降低了幼苗的蒸腾速率与气孔导度(P< 0.05), 接种17537与129则无显著影响(P> 0.05)。与此相反, 所有接种处理均提高了幼苗的水分利用效率, 其中接种17578菌株的增幅最大, 增幅为57%(P< 0.05)(图9)。
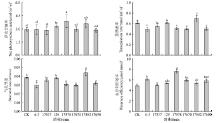 | 图9 接种根瘤菌对陇东苜蓿光合特性的影响Fig.9 Photosynthetic characteristics of Medicago sativa cv. Longdong under inoculation |
2.3.3 生物量构成因素的相关性分析 生物量与叶子数、株高、茎生物量、叶生物量、根生物量呈极显著正相关(P< 0.01), 相关系数分别为0.570、0.593、0.842、0.852、0.885; 与茎粗呈显著正相关(P< 0.05); 与比叶面积呈显著负相关(P< 0.05); 与叶面积、茎叶比、地上地下生物量相关不显著(P> 0.05)(表3)。
| 表3 陇东苜蓿生物量构成因素的相关性分析 Table 3 The relationships among seedling biomass components of Medicago sativa cv.Longdong |
根瘤菌对紫花苜蓿幼苗生长的影响与根瘤菌剂、苜蓿品种以及生长环境密切相关[12, 15, 16, 17]。与此相似, 本研究中无论是盆栽试验还是大田试验, 根瘤菌对紫花苜蓿幼苗生长的影响显著受接种菌株和苜蓿品种的影响, 如甘农3号接种17581菌株后幼苗长势较好, 但陇东苜蓿接种17581菌株后并没有表现出相同的优势。研究表明, 中苜1号接种6-3菌株后其幼苗长势较好[1], 与此一致, 陇东苜蓿接种6-3菌株后幼苗生物量增加了84%, 而甘农3号接种6-3菌株后幼苗生物量与对照无显著差异。
此外, 生长条件也是影响根瘤菌共生体固氮效率与生长的一个重要原因, 如本研究的温室条件下甘农3号接种17767菌株增产效果明显; 但在田间条件下, 甘农3号接种17767菌株没有表现出明显的增产效果。与此一致, 本研究发现, 在温室中表现出较好匹配性的根瘤菌-紫花苜蓿共生体在田间表现不一定好, 在田间具有良好表现的共生体在温室条件下也未必表现出相似特性。这种不一致性可能与土壤条件、肥力水平以及土著根瘤菌种类和数量不同有关[4]。在本研究中, 温室栽培基质为水洗砂, 其养分条件相对大田土壤较差, 因而在一定程度上会影响到苜蓿的结瘤特性。此外, 尽管田间试验所用土壤经过一定的灭菌处理, 但由于种子是直接播种于大田, 土著根瘤菌的影响不可避免[18]。有研究表明, 在试验室条件下筛选出的根瘤菌应用到田间时与土著根瘤菌相比其竞争性不一定强[11]。因此, 在筛选菌株时应通过田间试验来检测并以田间试验结果为主。
在大量根瘤菌筛选的研究中, 有效根瘤数是筛选与之最佳共生匹配菌株的重要指标[1, 8, 19, 20]。值得注意的是, 本研究发现, 结瘤数多少与苜蓿生长状况没有必然的联系, 如在大田试验中陇东苜蓿接种菌株6后, 结瘤数相对较少, 但其生物量明显高于其它处理; 甘农3号也有类似表现。有研究认为, 结瘤数并不能显示固氮能力, 可能是由于菌株的占瘤率与结瘤率存在差 异, 接种某些根瘤菌所获得的根瘤可能不是该菌株形成的[1, 8, 21, 22, 23]。
一般而言, 接种根瘤菌能够改善宿主植物的营养状况进而使其光合性能得以提高[24]。在本研究中, 7个接种处理的生物量都高于对照, 但只有接种17582、17578、129菌株提高其光合速率, 这表明根瘤菌接种后不仅影响其同化作用, 也可能通过其它途径来影响植物的生长。如有研究表明, 接种根瘤菌后可显著提高植物的抗逆性[25, 26]。与此一致, 本研究发现, 所有根瘤菌接种处理均不同程度地提高了植物的水分利用效率。这种变化可能通过两个途径实现, 一是提高植物的净光合速率; 二是影响其气孔开度, 降低其蒸腾速率。这一发现表明, 接种根瘤菌对于植物在干旱区的生长可能具有重要意义。在大豆(Glycine max)上有类似的报道[24]。
根瘤菌接种对光合速率的影响因接种菌株、接种植物等不同而异[27]。如, 对紫花苜蓿接种根瘤菌后, 其光合作用增强[28]; 将4种根瘤菌分别接种到木豆(Cajanus cajan)、银合欢(Leucaeua leucocephala)、滇合欢(Albizia simeonis)的一年龄幼苗上后, 苗木结瘤可以提高其净光合速率[29]; 接种根瘤菌显著提高大豆的光合能力[24]。
根、茎、叶是构成植物生物量的主要因素。本研究中, 多数接种处理都提高了植物的根、叶生物量, 但对茎生物量的影响无明显规律, 说明接种根瘤菌后有利于植物生物量向叶和根系分布, 这一方面有利于增加植物的同化面积, 另一方面则有利于植物通过根系获取水分养分, 提高其抗逆性[30]。这与茎叶比、地上/地下生物量的结果一致。也有研究[1, 31, 32]发现, 接种根瘤菌能提高地上、地下生物量, 减小茎叶比。值得注意的是, 接种根瘤菌降低了植物的比叶面积, 这一变化有利于提高单位叶面积的光合效率和水分利用效率。接种根瘤菌有提高紫花苜蓿茎粗的倾向[28], 但在本研究中, 接种根瘤菌后, 茎粗下降, 但其生物量则因接种菌株不同而异, 这可能与研究的物种及其生长环境有关。
1)结合温室沙培与田间试验(为主), 筛选出了不同苜蓿品种最佳共生匹配的根瘤菌菌株, 甘农3号-B2, 陇东苜蓿-17650。
2)结瘤数与紫花苜蓿幼苗生长特性没有必然的联系, 因而不建议将结瘤数作为筛选高效菌株的关键指标。
3)接种根瘤菌显著提高植株的水分利用效率。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|