第一作者:陈连民(1991-),男,江苏阜宁人,在读硕士生,研究方向为反刍动物瘤胃微生物代谢与调控。E-mail:LianminChen@yeah.net
有关瘤胃酸中毒发生机制研究表明,瘤胃乳酸的累积可能对酸中毒诱导起重要作用,而高精料日粮下瘤胃乳酸累积主要取决于瘤胃乳酸产生菌和乳酸利用菌间的平衡程度。本文综述了瘤胃微生物对乳酸的代谢机制,包括主要乳酸产生菌[溶纤维丁酸弧菌( Butyrivibrio fibrisolvens)、牛链球菌( Streptococcus bovis)、乳酸杆菌( Lactobacillus)]和主要乳酸利用菌[反刍兽新月单胞菌( Selenomonus ruminantium)、埃氏巨型球菌( Megasphaera elsdenii)],并简要概述了酸中毒的调控方法,旨在为反刍动物瘤胃酸中毒的乳酸中毒机制深入解析提供参考。
Reviews of the ruminant lactic acidosis indicated that accumulation of lactic acids in the rumen may play an important role in inducing ruminal lactic acidosis, while rumen lactic acids accumulation mainly depends on the degree of balance of rumen producing and utilizing bacteria in feeding high concentrate diets. In this paper, advances in lactic acids metabolism associated rumen bacteria ( Butyrivibrio fibrisovens, Streptococcus bovis, Lactobacillus, Selenomonus ruminantium and Megasphaera elsdenii) were discussed, prevention strategies of ruminal acidosis were discussed in purpose to provide reference for further research of lactic acids rumen acidosis mechanism.
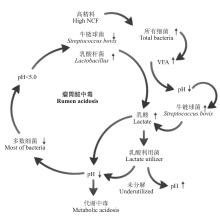
我国优质牧草资源相对匮乏, 为追求高生产性能, 进行集约化生产, 常以高淀粉含量精料饲喂高产奶牛和高强度育肥肉牛、肉羊, 导致瘤胃酸中毒的发生率逐年升高[1]。通常情况下, 反刍动物瘤胃pH值维持在6.5~7.5, 若长期饲喂高精料或突然采食大量易发酵碳水化合物饲料, 瘤胃出现代谢紊乱, 瘤胃中短链脂肪酸和乳酸积累, 致使pH值不同程度地下降, 诱发代谢性瘤胃酸中毒(图1)[2, 3]。瘤胃酸中毒有亚临床型和急性型之分。一般认为, 瘤胃内pH 值长时间稳定在5.0~5.5即发生亚临床酸中毒; pH值低于5.0即发生急性酸中毒。发生急性酸中毒动物的瘤胃和小肠上皮遭到损害, 表现出较明显的临床症状, 容易被发现, 并得到及时防治。而发生亚急性酸中毒的牛一般没有明显的临床症状, 且因没有适宜的诊断手段而更具有隐蔽性和隐患性, 成为现代反刍动物生产中的突出问题[4, 5]。关于瘤胃酸中毒产生机制, 主要分为3种:有机酸中毒学说、内毒素和组织胺中毒学说、乳酸中毒学说。目前国际上多数学者认同“ 乳酸中毒学说” , 即瘤胃内微生物代谢紊乱, 特别是乳酸产生菌与乳酸利用菌之间菌群失调导致瘤胃内乳酸积累是诱发瘤胃酸中毒的直接原因[6, 7, 8]。瘤胃乳酸产生菌主要包括溶纤维丁酸弧菌(Butyrivibrio fibrisovens)、牛链球菌(Streptococcus bovis)、乳酸杆菌(Lactobacillus)等; 乳酸利用菌主要包括反刍兽新月单胞菌(Selenomonus ruminantium)、埃氏巨形球菌(Megasphaera elsdenii)等。本文综述了与瘤胃乳酸代谢相关的主要瘤胃微生物的最新研究进展及瘤胃乳酸中毒调控方法, 旨为瘤胃乳酸中毒机制的深入解析提供参考。
饲粮中碳水化合物的组成(易发酵碳水化合物的比例)和浓度引起的瘤胃微生物区系变化是瘤胃酸中毒的诱因。通常情况下, 反刍动物采食低NFC/NDF饲粮后, 通过瘤胃微生物的发酵, 产生挥发性脂肪酸(VFA), 随后被瘤胃壁迅速吸收利用。而产生的乳酸较少, 且被乳酸利用菌迅速分解为VFA等, 因此在瘤胃液中几乎检测不到[9]。但当大量采食以淀粉为主的高NFC/NDF饲粮时, 淀粉分解菌会爆发性地增殖并产生大量VFA, 导致瘤胃无法及时吸收, 造成总VFA的累积, 平均含量超过60 mmol·
溶纤维丁酸弧菌属于丁酸弧菌属, 是严格厌氧型革兰氏阳性菌, 瘤胃中该菌菌株种类多、差异大、可发酵底物广且发酵产物丰富, 主要包括乳酸、乙醇及甲酸、乙酸、丁酸等, 且该菌乳酸的生成途径主要是依赖于乳酸脱氢酶实现丙酮酸向乳酸的转化[12]。瘤胃特定种类的B. fibrisolvens菌株能够发酵饲粮中的淀粉, 产生大量的乙酸和乳酸(> 50 mmol· L-1), 同时可以促进其它乳酸产生菌的增殖[13]。日粮不同NFC/NDF比例对瘤胃B. fibrisolvens菌群数量变化的影响研究发现, 随饲粮NFC/NDF提高, 初期菌群数量迅速上升且瘤胃液VFA和乳酸的浓度都有提高; 而当NFC/NDF比例升高至瘤胃产生亚急性酸中毒时, 其菌群数量出现迅速下降趋势。这可能与高精料引起瘤胃pH值的下降有关, 因为该菌对环境pH值的变化比较敏感, 低pH环境会抑制其生长[14]。
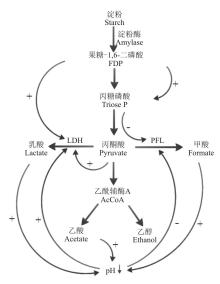
特定B. fibrisolvens菌株体外培养研究乳酸产生规律发现, 高产菌株能将培养基中75%葡萄糖转化为乳酸。相对产乳酸能力较差的菌株, 高产菌株乳酸脱氢酶的活性比低产菌株高10倍以上[15]。乳酸脱氢酶活性受培养基果糖-1, 6-二磷酸(FDP)浓度及pH值等因素影响。当FDP浓度低于1 mmol· L-1时, 乳酸脱氢酶才会得到激活(0.2 mmol· L-1时激活程度最大), 高浓度则会抑制其酶活性, 减少乳酸的产生[16]; 当环境pH值从7下降到6时, 乳酸脱氢酶活性也会进一步受到抑制, 导致体外连续培养条件下pH值下降而乳酸浓度并未提高(图2)[17]。
另外, 相关研究也发现, 向乳酸高产菌株培养基中添加低浓度乙酸(5 mmol· L-1)能够使乳酸的产量显著降低, 糖酵解产物优先转向丁酸生成途径, 这可能是由于乳酸高产菌株不具备丁酸激酶活性, 但具备较高的丁酰辅酶A/乙酰辅酶A转移酶活性, 可以直接利用乙酸作为受体, 将丁酰辅酶A转换生成丁酸[15]。然而, 通常情况下瘤胃乙酸浓度都在5 mmol· L-1之上, 果糖-1, 6-二磷酸浓度高于1 mmol· L-1, 并且慢性瘤胃酸中毒(subacute rumen acidosis, SARA)发生时瘤胃pH值长时间稳定在5.2~5.6[18], 说明B. fibrisolvens并不是引起瘤胃乳酸大量积累的主要菌群, 但B. fibrisolvens菌群数量及产酸的改变却能在一定程度上反映瘤胃酸中毒的发生进程。
前人研究瘤胃酸中毒进程中瘤胃菌群结构变化时发现, 饲喂高精料日粮特别是含有较多容易发酵的NFC等会引起瘤胃中S. bovis数量爆发式增长, 并且发酵产生大量乳酸, 造成瘤胃乳酸的累积(主要为L-型乳酸)进而导致pH值迅速下降, 由此认为该菌对瘤胃急性酸中毒的发生至关重要[19, 20]。
瘤胃S. bovis除了可以发酵产生乳酸外还可以产生甲酸、乙酸以及乙醇等, 且产酸类型受环境pH及底物NFC供应影响较大, 具体表现为:pH值高于6.0时, 发酵产物丰富, 以甲酸、乙酸及乙醇为主, 且此时菌群保持相对较低的生长速率; pH值在5.0~6.0且底物多为易发酵NFC时, S. bovis会大量繁殖, 并发酵产生大量乳酸; pH值低于5.0时, 该菌增殖速率显著降低(P< 0.05), 但发酵产物仍为乳酸[1, 17]。
pH和底物NFC浓度变化对S. bovis产酸影响的研究发现, 不同pH及底物NFC浓度通过影响酵解途径中间产物及产酸路径中相关酶的活性来改变产酸速率及类型。S. bovis乳酸产量很大程度上取决于乳酸脱氢酶(LDH pH为5.5时其酶活力最高)的量和活性, 低pH、高NFC浓度底物可促进S. bovis编码LDH的基因mRNA表达, 提高LDH合成量, 促进NADH作为还原剂, 将丙酮酸转化为乳酸[21, 22]; 甘油醛-3-磷酸脱氢酶(GAPDH)也与S. bovis产乳酸性能关系密切。丙酮酸转向乳酸的过程中需NADH作H+供体, 而NADH的供应依赖糖酵解途径中甘油醛-3-磷酸在GAPDH作用下脱氢生成1, 3-二磷酸甘油时NAD+作H+受体形成NADH。NAD+与NADH间的转化效率长期以来被认为影响乳酸产量的一个重要限制因素, 因而, GAPDH被认为与S. bovis发酵产乳酸性能关系密切[23, 24]。但最近Asanuma等[21, 25]通过构建高GAPDH基因(gapA)表达S. bovis, 研究不同NAD+与NADH间转换效率对乳酸产量的影响发现, GAPDH的差异表达并未改变乳酸的产生速率, 认为GAPDH作为关键酶参与糖酵解进程但对乳酸合成调控作用甚小。
另外, S. bovis菌株LDH与丙酮酸甲酸裂解酶(PFL)(pH为7.5时其酶活力最高)的相对优劣势也会对丙酮酸去路产生影响。PFL能够将丙酮酸转化为甲酸并催化辅酶A形成乙酰辅酶A, 再经其它酶作用生成乙酸、乙醇等[17]。当PFL相对LDH占优势时, 丙酮酸的去路更多地向甲酸、乙酸及乙醇等转变。但PFL活性受pH影响很大, pH值低于5.7时其酶活被抑制, 而LDH酶活则被激发, 产生大量乳酸诱导瘤胃酸中毒的发生[26]; 酵解途径中间产物FDP、二羟丙酮磷酸和甘油醛-3-磷酸等也会对LDH和PFL活性产生影响。高FDP浓度能够激活LDH, 且FDP在醛缩酶作用下生成的二羟丙酮磷酸和甘油醛-3-磷酸抑制PFL活性, 以致低pH、高糖酵解条件下丙酮酸向甲酸的转换减少, 更多地转向产生乳酸[26, 27]。
瘤胃中乳酸杆菌的种类众多, 易分离得到的包括嗜酸性乳酸杆菌(L. acidophilus)、干酪乳酸杆菌(L. casei)、发酵乳酸杆菌(L. fermentum)等[28]。通常情况下, 瘤胃Lactobacillus并不是优势菌群, 但在急性酸中毒奶牛瘤胃中却占优势。这种优势菌群的形成与S. bovis大量增殖导致的乳酸积累关系密切。高精料条件下S. bovis迅速增殖产酸对瘤胃pH值降低起到了关键的作用, 其营造的低pH值环境抑制了绝大多数不耐受酸菌的活力[14, 29, 30]。当pH下降到5.0时, 厌氧性Lactobacillus大量增殖。Lactobacillus发酵碳水化合物以产D-型乳酸为主[30]。在日粮NFC诱导瘤胃酸中毒发生的过程中, 随着瘤胃乳酸积累, 瘤胃内L-型乳酸浓度较低, D-型乳酸的浓度则逐渐上升[31]。这是由于瘤胃广泛存在L-型乳酸脱氢酶而缺乏D-型乳酸脱氢酶, D-型乳酸主要依赖瘤胃上皮细胞吸收后经线粒体中D-型乳酸脱氢酶代谢, 但由于瘤胃上皮对乳酸吸收效率有限, 因而无法将产生的大量D-型乳酸分解并代谢出瘤胃, 造成D-型乳酸大量积累, 引发瘤胃酸中毒[29]。
当瘤胃pH值降到4.5以下时, Lactobacillus成为瘤胃绝对优势菌群, 瘤胃菌群结构多样性急剧减少, 即使是胞内pH值能够随环境pH下降而降低, 但具极强耐酸性的S. bovis也逐渐消失。相关研究认为, 这可能与Lactobacillus大量增殖引起菌群间的竞争抑制以及菌体自身感应调控作用有关。Asanuma等[32]发现, S. bovis存在一种信号感受基因luxS, 该基因介导的信号系统能够感受到复杂多变的瘤胃环境并对菌体生理和代谢功能进行调节; Wells等[33]证实瘤胃pH进一步降低过程中, Lactobacillus相对S. bovis形成优势菌群是因为Lactobacillus大量增殖时能够产生一种抑制S. bovis增殖的细菌素。
M. elsdenii是瘤胃中最主要的乳酸分解菌, 除了与乳酸产生菌竞争性地利用底物发酵产生的葡萄糖、麦芽糖等外, 更偏好分解乳酸作为自身增殖产酸的碳源[34]。但也有学者通过体外法研究M. elsdenii在乳酸、葡萄糖、麦芽糖等培养基中的增殖规律, 发现含乳酸培养基并未形成增殖优势[35]。一般乳酸分解菌生长最适pH值在6.0~6.5, 当瘤胃pH值下降到5.5时多数乳酸分解菌活动受到抑制, 而M. elsdenii却还能利用乳酸进行代谢[36]。瘤胃中超过70%的乳酸能被M. elsdenii分解利用, 如其它乳酸降解菌无法利用的D-型乳酸也能够被其发酵。M. elsdenii酵解乳酸产物主要为丙酸、丁酸及少量的乙酸、戊酸等。在饲喂高精料饲粮的绵羊瘤胃中, 埃氏巨型球菌占乳酸利用菌总数的21%[37], 因此, 对于瘤胃酸中毒发生起着至关重要的缓解作用[38, 39]。
M. elsdenii利用乳酸产生丙酸主要通过丙烯酸和琥珀酸两条途径, 其中丙烯酸途径是最主要的丙酸产生途径[38, 40]。丙烯酸途径中, L-型乳酸通过丙烯酸被转化为丙酸, 而D-型乳酸则经D-型乳酸脱氢酶作用生成丙酮酸或经乳酸消旋酶转化为L-型乳酸后再进一步代谢; 琥珀酸途径中, 先由乳酸脱氢酶转化为丙酮酸, 再经苹果酸和富马酸生成琥珀酸, 最后由琥珀酸脱羧生成丙酸。另外, M. elsdenii也可以通过乙酰辅酶A途径产生乙酸。
M. elsdenii乳酸代谢产物受发酵底物的组分及葡萄糖浓度等影响。在高NFC日粮饲喂条件下, 乳酸-丙烯酸途径是其生成丙酸的主要途径。即, 由乳酸转化为乳酰辅酶A, 进而转化为丙烯酸辅酶A, 再由丙烯酸辅酶A加氢还原为丙酸; Marounek等[34]通过体外培养法研究底物葡萄糖对M. elsdenii乳酸代谢产物组成的影响发现, 底物添加葡萄糖后乳酸代谢产物丁酸、戊酸和己酸产量升高, 而丙酸的产生则出现了一定程度地下降, 认为这是因丙酰辅酶A代替乙酰辅酶A, 实现二碳基团向三碳基团的快速转变从而促进了戊酸的产生。另外, 高精料日粮也可导致瘤胃微生物细胞间氢(H+)积累, 一些电子受体(如苹果酸、延胡索酸、富马酸等)可将瘤胃微生物发酵过程中产生的氢离子转移而抑制乳酸-丙烯酸途径[41]。
S. ruminantium是瘤胃内重要的革兰氏阴性菌, 约占瘤胃细菌总数50%以上, 生存最适pH为6.0~6.5。可降解瘤胃累积的乳酸形成乙酸和丙酸, 并在瘤胃琥珀酸-丙酸生成过程中起重要作用。另外其还具脱羧基作用, 能使琥珀酸脱羧形成丙酸, 因此这类微生物在瘤胃乳酸代谢中起着重要作用[42, 43]。虽然该菌占瘤胃内可培养细菌的22%~51%, 但其中具有乳酸降解能力的菌株只占不到1%[44]。
S. ruminantium不能发酵纤维素、木聚糖或果胶, 但可利用纤维二糖、麦芽糖和单糖等降解产物。S. ruminantium发酵乳酸的能力因可溶性糖的增加受到抑制[45, 46], 且受环境pH值影响较大。大量易发酵碳水化合物饲料饲喂诱发的酸中毒前期, 乳酸利用菌快速产生乳酸, 同时主要乳酸利用菌S. ruminantium也迅速增殖[19, 47, 48]。当瘤胃pH值低于6.5时, S. ruminantium的生长速度随着瘤胃液pH值的下降而减缓。而S. bovis和S. ruminantium在瘤胃液中最终消失的pH阈值分别为4.8和5.4[19, 45, 49], 可见乳酸利用菌的耐酸性能较弱。因此, 在瘤胃pH值高于5.5情况下由于乳酸利用菌S. ruminantium等的代谢作用, 瘤胃液中乳酸含量较低。但随着瘤胃pH进一步下降, S. ruminantium等的作用受到抑制, 乳酸产生菌产生的大量乳酸由于不能被及时吸收利用, 致使瘤胃内乳酸浓度蓄积, 瘤胃酸度剧烈上升。当pH值继续下降至5.5左右时, 如瘤胃能源充足, S. bovis等继续生长繁殖, 产生的乳酸导致瘤胃pH值进一步下降, 大部分细菌包括S. ruminantium数量急剧减少、消失, 瘤胃中乳酸大量累积, 由此加速了酸中毒进程。
传统的通过饲粮添加或口腔灌注缓冲剂可以在一定程度上稳定瘤胃pH值, 缓解乳酸中毒, 但瘤胃乳酸中毒归根结底是乳酸的产生与分解不平衡造成瘤胃乳酸的积累。因此, 调控瘤胃乳酸中毒的根本在于实现乳酸产生与分解利用的代谢平衡。生产中可以通过减少瘤胃微生物乳酸的产生及提高乳酸利用菌对乳酸的分解代谢以避免瘤胃乳酸中毒的发生。
4.1.1 优化饲养与管理 奶牛饲养中饲喂不及时造成饥饿状态下大量采食, 特别是精粗分开饲喂情况下易引起VFA和乳酸的大量累积。饲养中可以通过控制饲喂量, 实行少量多次的全混合日粮(TMR)饲喂, 这可以有效避免有机酸的大量产生、累积, 降低瘤胃乳酸中毒发生的风险[1, 50]。对饲粮中的碳水化合物进行适当处理或者合理设计也可以达到减少瘤胃乳酸累积的目的。具体可通过提高日粮物理有效中性洗涤纤维含量, 刺激瘤胃发育, 增加反刍次数及瘤胃的蠕动频率, 达到维持瘤胃pH值的稳定[51, 52, 53]。也可以通过对玉米(Zea mays)等谷物进行加热压片、糊化等手段改变淀粉结构, 降低易消化淀粉比例达到减缓淀粉发酵产酸速率, 延长其在瘤胃中的发酵时间, 达到减少乳酸产生的目的[54]。另外, 添加剂方面苹果酸、琥珀酸和延胡索酸等有机酸电子受体, 可以将发酵过程中产生的氢转移, 氢的减少可以促进丙烯酸途径发酵的正常进行, 从而降低乳酸的产生[55]; 添加阿卡波糖等酶活抑制剂, 竞争性抑制α -淀粉酶和α -葡萄糖苷酶的酶活性, 减缓单糖的生成速度, 调节以淀粉为首的易发酵碳水化合物发酵产酸速率, 以减少乳酸产生[56]。
4.1.2 抑制乳酸产生菌的大量增殖 抑制乳酸产生菌大量增殖, 避免其成为瘤胃优势菌群也是有效减少瘤胃乳酸累积的有效方法之一。抑制方法主要包括两种:其一, 接种S. bovis、乳酸杆菌等主要乳酸产生菌疫苗, 刺激机体产生相应的抗体, 可以显著降低乳酸产生菌数量, 减少乳酸产生[57]。其二, 使用莫能菌素、维吉尼亚霉素等离子载体类抗生素, 造成S. bovis胞内外Na+-Ca2+离子交换失衡, 引起其大量裂解死亡, 减少乳酸产生[58]。但因抗生素使用不当会造成其在畜产品中的累积, 影响食品安全, 因此已被禁用。
4.2.1 接种乳酸利用菌 M. elsdenii是瘤胃中的主要乳酸利用菌, 除可以分解利用乳酸外还可与S. bovis竞争性争夺葡萄糖、麦芽糖等底物, 抑制S. bovis生长[59]。一些研究表明, 瘤胃内接种该菌可有效减轻瘤胃乳酸酸中毒[60]。但成年泌乳牛外源补给的M. elsdenii并不能在瘤胃中长期存留形成稳定菌群, 需要持续添加。那么能否在犊牛瘤胃微生物区系形成前, 通过饲喂具有更强乳酸分解能力的外源基因工程改造M. elsdenii, 达到人为改变瘤胃M. elsdenii优势群落的目的, 这值得今后进行研究论证。
4.2.2 促进乳酸利用菌增殖 促进乳酸利用菌增殖可以提高产生乳酸的分解效率, 减轻瘤胃乳酸的积累负担。如:添加硫胺素, 可以促进酸利用菌及硫胺素合成菌的生长, 抑制乳酸产生菌及淀粉分解菌的繁殖, 促使瘤胃微生态恢复[45, 61]; 添加益菌素、酵母提取物等, 由于此类物质中含有益菌因子, 可以提高乳酸利用菌的活力及增殖速率, 从而加速对乳酸的分解代谢作用[62]。
目前, 有关瘤胃乳酸中毒机制的相关研究主要集中在不同精粗比及不同碳水化合物结构日粮条件; 反刍动物瘤胃乳酸产生规律及主要瘤胃乳酸代谢微生物的菌群结构变化情况; 亦或是通过体外培养瘤胃主要乳酸代谢菌, 从而研究相关代谢产物对乳酸代谢的调控作用。而瘤胃乳酸中毒的根本原因归咎于瘤胃乳酸产生与代谢不平衡引起的瘤胃乳酸累积, 进而造成代谢性毒症。但有关瘤胃内主要乳酸代谢菌在瘤胃乳酸合成和分解代谢路径上的研究仍停留在20世纪八九十年代, 通过同位素标记研究代谢产物提出几种可能代谢途径。因此, 未来更多的研究应转向通过借助现代先进技术如代谢组学等, 进一步阐明瘤胃微生物乳酸合成及代谢通路, 并通过调控瘤胃中的乳酸代谢途径减少瘤胃酸中毒的发生。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|