第一作者:雷娅红(1991-),女,甘肃定西人,在读硕士生,主要从事禾草内生真菌研究。E-mail:leiyh14@163.com
采用平皿测定法对我国北京口岸2014年进境草种高羊茅( Festucaarundinacea)、多年生黑麦草( Loliumperenne)和苏丹草( Sorghumsudanense)携带真菌进行分离培养,利用ITS4和ITS5引物对其内转录间隔区(InternalTranscribedSpacer,ITS)进行扩增,PCR产物纯化后测序并与数据库中的已知序列进行BLAST比对,对种带真菌进行初步鉴定。研究结果表明,不同来源种子携带真菌种类差异较大,从5个国家的7个进境草种批次中共检测出13属21种48株真菌,主要菌群为镰刀菌属( Fusariumspp.)、曲霉属( Aspergillusspp.)、茎点霉属( Phomaspp.)和链格孢属( Alternariaspp.)。基于ITS序列构建系统发育树,能够将所有分离到的真菌鉴定到属,但是在种水平上鉴定有限,不能将细极链格孢( Alternariatenuissima)、细交链孢( A.alternata)和乔木链格孢( A.arborescens)很好地区分开。本研究明确了5个来样量较大国家的草种带菌情况, ITS基因能够运用于口岸草种携带真菌的初步检测鉴定。
The 7 grass seed samples imported from 5 countries were analyzed for seed-borne fungi by Petri-dish testing. The samples included perennial ryegrass ( Loliumperenne), tall fescue ( Festucaarundinacea) and sudan grass ( Sorghumsudanense) in 2014. The ITS (Internal transcribed spacer) segment was amplified using ITS4 and ITS5 as primers, then purified and sequenced. The ITS sequences obtained were blasted with known ITS sequences in database. The results showed that 48 fungal strains belonged to 21 species of 13 genera were isolated, and the seed-borne fungal species of seed samples were significantly different from each other. The fungal species were mainly Fusarium spp. Aspergillus spp., Phoma spp., and Alternaria spp.. According to the ITS phylogenetic tree, all fungi could be identified to genus, which were hard to species. Alternariatenuissima, A.alternata, and A.arborescens couldn’t be separated. The study analyzed seed-borne fungi of imported grass seeds from 5 countries, and the ITS sequences were applied for seed-borne fungi of imported grass seeds preliminary detection and identification.
随着我国农牧业和草业种植结构的调整, 牧草种子需求量连年上升, 供求严重失衡[1], 黑麦草属(Lolium)和早熟禾属(Poa)等属草种进口量总体大幅度增长[2], 草种进口量的增长使得其携带病原真菌的机率大大提高, 很多病原菌对种子发芽、种苗活力都有一定的负作用, 严重影响农业发展, 造成巨大经济损失。如细交链孢(Alternariaalternata)、镰刀菌属(Fusarium spp.)、茎点霉属(Phoma spp.)等病原真菌都可引起黑麦草(L.perenne)及高羊茅(Festucaarundinacea)等草坪草发生病害, 造成一定的经济损失[3, 4]。真菌病害引起的各种叶枯、叶斑、腐烂、坏死等症状严重影响草坪质量和美观[5]。近几年来, 北京口岸入境草种数量连续位居全国第一, 据统计从2009年到2013年, 北京口岸入境草种总量近7.5万t, 如此大规模草种通过口岸入境给检验检疫带来巨大压力, 因此, 对进境草种进行病原真菌快速检测至关重要, 同时对检测出的真菌进行准确分类, 也是深入开展我国进出境口岸检疫性工作的必要前提和基础。口岸检疫主要采用传统的形态学方法对病原菌进行检测鉴定, 缺乏有效高通量的检测手段, 难以满足日益增长的检疫要求。目前内转录间隔区(Internal Transcribed Spacer, ITS)基因已被广泛用于真菌分类及鉴定[6, 7, 8], 在真菌中整体的识别成功率可以达到72%[9]。ITS基因在不同物种间存在丰富的变异, 为病原菌的分类鉴定及系统发育等研究提供了十分重要的依据, 而且为建立病原菌的分子监测与疫病的快速诊断技术奠定了基础, 对植物病害的防治具有重要意义[10]。
本研究利用ITS基因结合形态学系统性地对我国来样量较大的5个国家的几个重要草种种带真菌进行了检测鉴定, 旨在明确我国进出境口岸草种的带菌情况, 对草种质量进行评价, 为客户购买提供参考和指标, 为快速通关提供技术支持, 为进出境检疫管理部门提供执法依据。
1.1.1 供试草种 2014年7个草种批次, 来源于美国、新西兰、澳大利亚和丹麦的多年生黑麦草(Loliumperenne), 来源于美国的高羊茅(Festucaarundinacea)以及来源于加拿大的苏丹草(Sorghumsudanense), 由北京出入境检验检疫局检验检疫技术中心提供, 材料详细信息如表1所示。
| 表1 进境牧草种样 Table1 The imported grass samples used in this study |
1.1.2 主要试剂和仪器 ABPDA(AntibioticPotatoDextroseAgar, 含抗生素青、链霉素各100mg· L-1的马铃薯葡萄糖琼脂培养基); 植物基因组试剂盒, 1× TAE电泳缓冲液购自天根生化; DL2000Marker购自宝生物(大连)工程有限公司。
培养箱为日本三洋公司生产的WE52B5-959型; OlympusBX51显微镜; PCR仪, 凝胶成像系统分别为美国伯乐公司生产的icyclerthermalcyci型和UniversalHoodII型。
每个种子批次随机取200粒草种, 不经表面消毒, 直接均匀地摆放于ABPDA平板培养基上, 每皿10粒, 5皿为一重复, 共设4个重复, 于25℃黑暗条件下培养, 每天进行观察, 挑取真菌菌丝到新鲜PDA平板中进行纯化保存、镜检[11]。参考《真菌鉴定手册》[12], 利用分子生物学技术结合真菌形态特征观察进行初步鉴定, 并计算每种菌的分离率。
分离纯化的真菌在ABPDA培养基培养14d后, 采用天根生化植物基因组试剂盒提取各种带真菌DNA。具体步骤为:取约100mg新鲜菌丝加入液氮充分碾磨; 迅速转移到预先装有700μ L65℃预热缓冲液GP1的离心管中, 颠倒混匀后, 65℃水浴20min; 加入700μ L氯仿, 充分混匀, 12000r· min-1离心5min; 取上层水相置新的离心管中, 加入700μ L缓冲液GP2; 混匀后, 转入吸附柱CB3中, 12000r· min-1离心30s, 弃废液; 向CB3中加入500μ L缓冲液GD, 12000r· min-1离心30s, 弃废液, 将CB3放入收集管中; 向CB3中加入600μ L漂洗液PW, 12000r· min-1离心30s, 弃废液; 重复上次步骤; 将CB3放回收集管中, 12000r· min-1离心2min, 弃废液; 将CB3置于室温放置数分钟, 以彻底晾干吸附材料中残余的漂洗液, 转入一个干净的离心管中, 向吸附膜的中间部位悬空滴加50~200μ L洗脱缓冲液TE, 室温放置2~5min, 12000r· min-1离心2min, 将溶液收集到离心管中, 于-20℃保存备用。
利用真菌ITS通用引物对ITS4(5’ TCCTCCGCTTATTGATATGC3’ )和ITS5(5’ GGAAGTAAAAGTCGTAACAAGG3’ )[13]进行PCR扩增。PCR反应体系为25μ L, 含2× TaqPCRMasterMix溶液(天根生化), 各引物(浓度10μ mol· L-1)1μ L, 模板2μ L, 补充ddH2O至25μ L。扩增程序为:94℃预变性5min; 94℃变性30s, 52℃退火30s, 72℃延伸1min, 34个循环; 72℃延伸7min。PCR扩增产物用1.5%的琼脂糖凝胶进行电泳检测, 点样5μ L, 用1× TAE电泳缓冲液在100V的电场下电泳30min左右, 然后利用紫外凝胶成像仪观察照相并分析。PCR产物切胶回收送样上海英俊公司进行测序, 所有序列提交至Genbank数据库(http://www.ncbi.nlm.nih.gov/genbank)。
经分离培养, 利用ITS序列结合形态学特征观察从7个进境草种批次中共检测出13属21种48个菌株。不同草种携带的真菌种类差异较大, 加拿大苏丹草(J-1)和丹麦多年生黑麦草(D-1)主要携带球状茎点霉(P.glomerata), 分离率分别为36.3%和40.0%; 澳大利亚多年生黑麦草(A-1)主要携带出芽短梗霉(Aureobasidiumpullulans), 分离率为28.5%; 美国多年生黑麦草(M-1)主要携带浸染链格孢(A.infectoria), 分离率为37.5%; 美国多年生黑麦草(M-2)主要携带双隔膜德雷克斯孢菌(Drechslerabiseptata), 分离率为33.3%; 新西兰多年生黑麦草(X-1)主要携带黑附球菌(Epicoccumnigrum), 分离率为50%; 美国高羊茅(G-1)仅携带亮白曲霉(A.candidus), 分离率为100%(表2)。
| 表2 草种种带真菌种类及分离率(%) Table2 The percentage frequency(%) of fungi species isolated from seed samples |
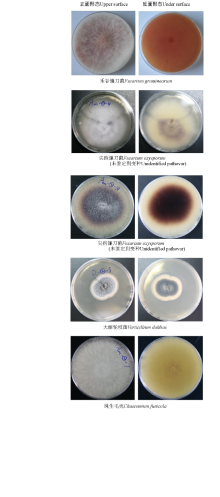
分离纯化的种带真菌在ABPDA培养基培养14d后, 利用单反数码相机拍摄菌落形态照片, 采用OlympusBX51显微镜观察孢子形态, 图1和图2分别为部分种带真菌菌落和孢子形态特征。
采用ITS4和ITS5引物扩增纯培养的种带真菌的ITS序列, 部分扩增产物的琼脂糖凝胶电泳检测结果如图3所示, 可看到扩增条带清晰明亮、无拖尾和杂带现象, 且各产物长度大约为500bp, 扩增效果良好, 说明样品符合测序要求。
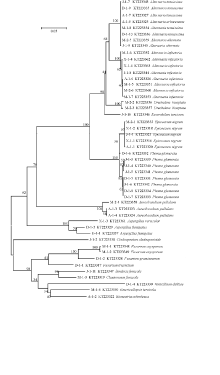
测序所得结果在GenBank数据库中进行同源性比对, BLAST结果表明, 各样品与数据库中属、种的相似度在98%以上, 能够将枝孢霉(Cladosporiumspp.)、镰刀菌(Fusariumspp.)、曲霉(Aspergillusspp.)、茎点霉(Phomaspp.)、链格孢(Alternariaspp.)和德氏霉(Drechsleraspp.)等真菌鉴定到属。进一步采用邻接法构建系统发育树, 所有的菌株均由本研究分离获得, 如图4所示, 不同的种均位于不同的末端分支, 同一个种的菌株都不同程度地聚在一起, 但是对于种的鉴定能力有一定的局限, 不能将细极链格孢(A.tenuissima)、细交链孢(A.alternata)和乔木链格孢(A.arborescens)等区分开。图4中系统发育树内容依次为本研究真菌编号、Genbank登录号以及真菌拉丁名。
目前DNA条形码技术广泛运用于物种的检测鉴定研究中, 国内外学者对真菌条形码技术也进行了大量研究, 在真菌分类鉴定工作方面也取得了突破性的进展[16]。由于真菌在ITS区大小合适、引物通用性强, 扩增成功率高、便于高通量测序[17], 以及ITS在真菌物种之间有广泛的序列多态性等特点, 使得ITS序列适合于真菌物种的分子鉴定和物种属间或种间差异较明显的菌群间的系统发育关系分析[9], 在2011年国际真菌DNA条形码工作会议上, ITS基因被确定为真菌鉴定的通用条形码。
本研究通过对草种携带真菌进行分离培养, 利用分子生物学技术同时结合形态学方法鉴定出13属22种48株种带真菌, 来源不同的草种带菌情况差异较大, 主要包括枝孢霉、镰刀菌、茎点霉、德氏霉、链格孢、轮枝菌、曲霉等真菌, 明确了我国口岸引自5个国家7个草种携带真菌情况, 为检疫部门对于草种携带真菌检测提供了理论依据。基于ITS基因构建的系统发育树(图4), 结果表明不同属的真菌独立形成一枝, ITS对于不同的属有较好的鉴别能力。但是在种水平上鉴定能力有限, 在Alternariaspp.形成的独立分支中, A.tenuissima, A.alternata和A.infectoria亲缘关系较近聚在一起, 这与李永等[18]研究结果一致, ITS不能将链格孢属亲缘关系较近的29个小孢子种区分开。后续研究需进一步结合DNA条形码技术筛选出合适的基因对其进行检测鉴定, 或利用多基因联合分析, 如Pryor和Bigelow[19]利用ITS、甘油醛-3-磷酸(glyceraldehyde-3-phosphatedehydrogenase, gpd)和线粒体小亚基核糖体(mitochondrialsmallsubunitrDNA, mtSSU)3个基因联合分析, 对链格孢属21个种进行系统发育分析。
外界环境条件适宜时, 种子携带真菌可能对植物健康生长产生严重的影响, 对我国草业生产造成重大的经济损失, 有研究表明, 草种携带的德氏霉属(Drechsleraspp.)、镰刀菌属(Fusariumspp.)、茎点霉属(Phomaspp.)等真菌能够侵染草坪草, 造成较为严重的危害[20, 21], 镰刀菌属、链格孢属(Alternariaspp.)、曲霉属(Aspergillusspp.)影响草种的萌发和出苗生长, 是许多草类苗期病害的病原, 也是某些重要病害的初侵染源之一, 在生产安全上不容忽视[22, 23]。孔瑞芳[24]对苏丹草种子和幼苗进行致病性测定发现, 大斑德氏霉(D.turcnica)、禾谷镰刀菌(F.graminearum)和燕麦镰刀菌(F.avenaceum)等分离自8个苏丹草品种上的病原真菌显著降低了种子发芽率、根长和苗长。本研究通过分离培养获得了镰刀菌、茎点霉、曲霉、轮枝菌及枝孢霉等真菌, 但尚未对分离的真菌进行致病性测定, 有待后续进一步完善。
研究结果表明, ITS序列能够有效地对真菌检测鉴定, 可以应用于口岸进境草种携带真菌初步鉴定, 为我国农业生产提供技术支撑。相对于传统的形态学鉴定方法, ITS序列分析用于真菌鉴定更客观高效[25], 本研究分离的种带真菌多数较难利用形态学观察确定, 仅有少数能较为准确的识别, 但仍需分子生物学技术加以辅助鉴定。ITS基因的广泛应用为真菌的准确分类鉴定提供有力的技术基础, 缩短了真菌鉴定时间, 加快了通关进程, 对检疫工作起到了积极的作用。但是ITS基因对于部分真菌不能够准确鉴定到种, 需要进一步筛选其它基因辅助鉴定, Genbank中含有大量的ITS序列信息, 构建并完善ITS序列数据库有利于实现对真菌高通量检测鉴定, 符合口岸快速通关要求, 易于标准化。
(责任编辑 王芳)
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|