第一作者:彭小群(1990-),女,广东化州人,在读硕士生,研究方向为草业生物技术与育种。E-mail:Q80266813@163.com
象草( Pennisetum purpureum)是一种广泛种植于热带和亚热带地区的多年生资源植物,但其木质素含量过高,影响了对其的开发与利用。为探讨肉桂酰辅酶A还原酶(Cinnamoyl-CoA Reductase,CCR)基因对木质素合成的影响,本研究以华南象草为材料,构建了 CCR基因正反义表达载体,并利用农杆菌侵染法转化烟草。通过Wiesner和Maule染色法对转基因植株进行木质素的组织化学染色。结果发现,转基因植株的木质素单体组成并没有明显改变;但 PpCCR过表达烟草,转基因株系木质化细胞增多; PpCCR反义表达烟草,转基因株系木质化细胞排列相对松散。同时反义表达 CCR,在木质素含量下降最明显的植株中茎秆呈红褐色。上述结果表明, CCR对木质素的合成起重要作用,这为进一步对象草进行遗传改良奠定了基础。
Pennisetum purpureum is a perennial resource plant and widely cultivated in tropical and sub-tropical regions. High lignin, however, to some extent, restricts the full use of it. In order to investigate the effect on the lignin synthesis by the cinnamoyl-CoA reductase (CCR) gene, P. purpureum cv. Huanan was selected to construct sense and antisense expression vector and transformed into tobacco by Agrobacterium infection method. The transgenic plants were histochemically stained by Wiesner and Maule reagents. Results showed that the composition of lignin did not change significantly, however, PpCCR overexpressing tobacco transgenic lines increased lignified cells while antisense expression lines with cells arranged loosely. Furthermore, the red-brown was found on the base of stem of the transgenic line with lignin content reduced sharply in tobaccos of the CCR antisense expression. The results emphasized the importance of CCR on the lignin synthesis and a foundation was laid for the genetic improvement of elephantgrass.
象草(Pennisetum purpureum)是禾本科狼尾草属多年生C4草本植物。象草具有生物产量大、再生能力强、适口性好、适应性广、抗逆性强等特点[1], 使之成为热带和亚热带广泛种植的资源植物。象草作为能源植物, 进行沼气发酵或乙醇生产时, 细胞壁中的木质素制约着微生物及酶对纤维素和半纤维素的降解, 木质素含量越低, 生物质能的转化效率越高[2]。若作为燃烧发电燃料, 则木质素含量越高越好[3], 而作为造纸原料, 为去除植物中的木质素, 需要消耗大量的硫酸和碱等化学物质, 容易造成环境污染[4]。作为饲用植物, 木质素含量越高, 草食动物的消化率越低[5]。因此, 通过基因工程手段对木质素合成进行调控, 对象草的研究具有重要的意义。
木质素是一种复杂的、非结晶性的、三维网状酚类高分子聚合物[6], 主要存在于植物细胞的次生壁, 与纤维素和半纤维素共价结合增强植物细胞和组织的机械强度[7]。木质素主要由对-香豆醇(p-coumaryl Alcohol)、松柏醇(Coniferyl Alcohol)与芥子醇(Sinapyl Alcohol)这3种单体, 经氧化物酶和漆酶等的氧化聚合分别形成对羟基苯基木质素(H-木质素)、愈创木基木质素(G-木质素)和紫丁香基木质素(S-木质素)[8]。木质素的生物合成非常复杂, 一般以苯丙酸起始, 经过一系列羟基化、甲基化、连接和还原反应生成单体, 单体进一步氧化聚合生成相应的木质素[9]。
肉桂酰辅酶A还原酶(Cinnamoyl-CoA Reductase, CCR)催化木质素单体生物合成的第一步氧化还原反应, 对木质素的生物合成起着重要作用。CCR催化5种肉桂酰辅酶A酯类底物(香豆酰辅酶A、咖啡酰辅酶A、阿魏酰辅酶A、5-羟基阿魏酰辅酶A和芥子酰辅酶A)生成相应的肉桂醛[10]。在木本植物如叶尾桉(Eucalyptus urophylla)[11]银合欢(Leucaena leucocephala)[12]、杨树(Populus tremula)[13]中下调CCR基因的表达均可以获得低木质素含量株系。在草本植物中通过下调CCR基因的表达获得低木质素转基因植株, 在玉米(Zea mays)[14]、小麦(Triticum aestivum)[15]、黑麦草(Lolium perenne)[16]、柳枝稷(Panicum virgatum)[9]、蒺藜苜蓿(Medicago truncatula)[17]中均有研究, 但利用基因工程手段调控象草CCR基因的表达研究其对植株木质素的影响尚未见报道。
本研究构建象草CCR基因的正、反义表达载体并通过根癌农杆菌介导法, 在烟草中对CCR基因的功能进行研究, 以期掌握象草CCR基因的表达特征, 为进一步对象草进行遗传改良奠定基础。
本研究试验材料为华南象草(P. purpureum cv. Huanan), 取自华南农业大学草业科学系引种园。载体pBA002/3HA、大肠杆菌(Escherichia coli)菌种TOP10和根癌农杆菌(Agrobacterium tumefaciens)EHA105均为实验室保存。PpCCR基因(登录号JN695588)为华南农业大学草业科学系草类生物技术与育种实验室前期克隆[18]。
高纯度质粒小提试剂盒、超纯RNA提取试剂盒、快速琼脂糖凝胶DNA回收试剂盒购自北京康为世纪生物科技公司。pMD18-T vector、dNTPs、RNA PCR Kit (AMV) Ver.3.0均购自TaKaRa公司。限制性内切酶、T4 DNA Ligase均购自Fermentas公司。
1.2.1 引物设计 根据PpCCR基因ORF序列, 利用Primer Primer 5.0软件设计特异性上下游引物, 同时分别在其5’ 和3’ 端引入Xba I和Bam HI酶切位点。正义表达载体上下游引物分别是CCR-F(5’ -GCTCTAGAATGACCGTGGTTGACGCCGTCT-3’ )和CCR-R(5’ -CGGGATCCTCACGCGCGG ATGGCGATCCCACC-3’ ), 反义载体上下游引物分别是AntiCCR-F(5’ -CGGGATCCATGACCGTGGTTGACGCCGTCTCC-3’ )和AntiCCR-R(5’ -GCTCTAGATCACGCGCGG ATGGCGATCCCACC-3’ )。所有引物均由上海生工生物技术公司完成。
1.2.2 目的基因的PCR扩增及纯化 以含有PpCCR基因的质粒为模板进行PCR扩增, 40 μ L扩增体系中含2× Taq MasterMix 20 μ L, 上下游引物(10 μ mol· L-1)各1 μ L, 模板1 μ L, 剩余体积用ddH2O补足。PCR反应程序为:1)95 ℃预变性5 min, 2)94 ℃变性 30 s, 3)60 ℃退火 35 s, 4)72 ℃延伸 1 min, 5)2~4步骤30个循环, 6)72 ℃ 延伸10 min。产物用1%琼脂糖凝胶电泳, 用康为世纪快速琼脂糖凝胶回收试剂盒回收纯化目的片段。
1.2.3 载体及目的基因的酶切与连接 用Xba I和Bam HI分别对目的片段和pBA002/3HA质粒载体进行酶切, 将酶切后的PpCCR基因与pBA002/3HA载体按照摩尔比3:1混合, 于16 ℃连接过夜, 转化大肠杆菌Top10感受态细胞, 在含有50 μ g· L-1卡那霉素的LB平板上筛选阳性克隆。用菌落PCR初步筛选阳性重组质粒, 提取阳性克隆质粒进行双酶切鉴定。
1.2.4 农杆菌介导的叶盘法转化烟草 烟草转化采用叶盘法[19]。无菌的烟草叶片切成0.5 cm× 0.5 cm大小, 移至预培养培养基(MS+0.5 mg· L-1 6-BA+0.1 mg· L-1 NAA)培养3 d。将预培养的叶盘转入农杆菌菌液中侵染15 min。用无菌滤纸吸干材料表面的菌液, 转入MS基本培养基中25 ℃暗培养。3 d后将叶盘用无菌水清洗再转入含500 mg· L-1 Cef无菌水清洗10 min, 尽可能去除叶盘表面的农杆菌。将材料转到分化培养基(MS+0.5 mg· L-16-BA+0.1 mg· L-1 NAA+5 mg· L-1 Basta+500 mg· L-1 Cef)中进行筛选培养。待抗性芽长至2~3 cm高时, 切下小芽转入生根培养基(1/2MS+0.2 mg· L-1 NAA+3 mg· L-1Basta+500 mg· L-1 Cef)中诱导生根。
1.2.5 转基因烟草阳性植株的PCR鉴定 提取转基因植物成熟叶片DNA, 根据pBA002/3HA载体除草剂基因序列设计上下游引物Bar-F(5’ -CGACTGCCAGAAACCCACGT-3’ )和Bar-R(5’ -CTGCACCATCGTCAACCACT-3’ )对转基因植株进行PCR鉴定。
1.2.6 除草剂检测 转基因株系移栽2~3周后, 选择野生型及转基因烟草同一位置的叶片标记位置涂抹1 mg· L-1 Basta, 4~5 d后观察并记录烟草叶片的枯死情况。
1.2.7 转基因植株的RT-PCR鉴定 采用超纯RNA提取试剂盒提取总RNA, 利用反转录试剂盒进行RNA反转录, 设计检测引物RTCCR-F(5’ -CACCGACGACCCCGAGCAAATGG-3’ )和RTCCR-R(5’ -GGAAGAGCTTGGCGAGGATGCGG-3’ )进行RT-PCR反应, 以ACTIN基因为内参, 检测基因的表达情况。
1.2.8 木质素的组织化学染色 将转基因烟草茎切片进行Maule染色和Wiesner染色[20]。Maule染色:用1% KMnO4溶液染色5 min, 转入 12%(v/v) HCl浸泡2 min后封片观察。Wiesner染色:切片用2%间苯三酚(溶于无水乙醇)染色5 min, 转入12 %(v/v)HCl浸泡5 min后封片观察。
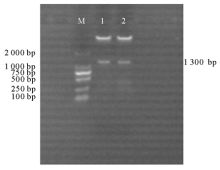
为研究PpCCR基因的功能, 构建了pBA-CCR正义和pBA-ACCR反义表达载体。用CCR-F/CCR-R和AntiCCR-F/AntiCCR-R对PpCCR编码区序列进行T-A克隆, 构建了克隆载体pMD-CCR。再利用Xba I和Bam HI对pMD-CCR和pBA002/3HA质粒载体进行双酶切, 将双酶切后的基因片段和pBA002/3HA进行连接并转化大肠杆菌Top10, 对正义和反义表达载体质粒用Xba I和Bam HI双酶切鉴定, 琼脂糖电泳检测后均可以得到1.3 kb 目的条带, 证明表达载体构建成功(图1)。
烟草叶盘经过预培养、农杆菌侵染、共培养后转移至含有5 mg· L-1Basta的分化培养基上筛选培养, 2~3周后, 叶盘边缘产生愈伤组织, 继而分化出抗性芽。以10 d为周期对烟草抗性芽进行继代培养, 待无菌苗生长至2~3 cm时转到生根培养基上诱导生根。待无菌苗生长出完整根系后对植株进行炼苗移栽。
选择野生型烟草及转基因植株叶片涂抹1 mg· L-1 Basta除草剂, 第5天观察发现, 野生型烟草叶片出现黄色枯斑, 26株PpCCR过表达烟草株系中有24株具有除草剂抗性(图2), 而24株PpCCR反义表达烟草中有18株具有除草剂抗性(图3)。
 | 图2 pBA-CCR正义表达载体烟草除草剂抗性检测注:a, 野生型烟草植株叶片; b, 假阳性烟草植株叶片; c, 抗性烟草植株叶片。图3同。Note: a, wild-type tobacco plant; b, false-positive tobacco plant; c, resistant tobacco plant. The same in Fig.3.Fig.2 pBA-CCR sense expression vector into tobacco by herbicide resistance detection |
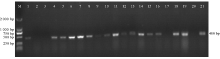
转基因植株移栽3~4周后, 取成熟叶片提取DNA, 分别选取22和19个正反义表达载体烟草株系利用Bar基因引物(Bar-F/Bar-R)进行PCR鉴定。结果表明, 用pBA-CCR正义载体转化烟草有20株植株能扩增出400 bp的Bar基因片段(图4)。而pBA-ACCR反义载体转化烟草仅有16株植株能扩增出目的片段(图5)。
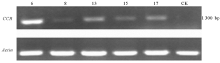
为了进一步研究基因在转录水平的表达, 本研究分别提取5个正、反义转化阳性株系和野生型烟草的RNA, 将其反转录为cDNA后利用引物(RTCCR-F/RTCCR-R)进行了RT-PCR检测。结果PpCCR过表达烟草的第6、8、13、15、17以及反义表达烟草的第13、14、16、19号株系cDNA均能扩增出1.3 kb的条带, 表明PpCCR能够在烟草中转录表达(图6、7)。
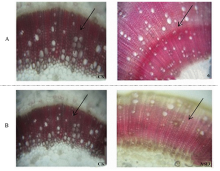
为研究PpCCR正反义表达烟草后对植株木质素含量和组成的影响, 利用Wiesner和Maule染色法对转基因株系的茎秆基部切片进行染色。Wiesner染色深浅可以粗略反映木质化细胞中木质素的总含量, Maule染色处理使S木质素呈红色, G木质素呈棕色, 可以大致反映木质素单体的组成。由Maule染色可以看出, 烟草茎中主要含有G木质素(棕色), PpCCR过表达或者反义表达烟草并没有明显改变烟草茎中的木质素单体组成, 但PpCCR过表达烟草, 转基因株系木质化细胞增多, PpCCR反义表达烟草, 转基因株系木质化细胞排列相对松散。PpCCR过表达烟草, CCR-6号株系木质部细胞着色明显比野生型深(图8A), PpCCR反义表达烟草, 相比野生型植株木质部细胞, 转基因植株木质部细胞染色相对较浅, 其中ASCCR-13号株系最为明显(图8B)。
 | 图8 烟草基部茎秆Maule染色处理(40× )注:A图表示PpCCR过表达载体转烟草茎秆基部染色; B图表示PpCCR反义表达载体转烟草茎秆基部染色。黑色箭头所指的是木质化细胞。图9同。Fig.8 Maule staining in tobacco stem base (40× )Note: A, PpCCR overexpression tobacco stained in stem base; B, PpCCR antisense expression tobacco stained in stem base. Black arrows indicate lignified cellular. The same in Fig.9. |
由Wiesner染色可以看出, PpCCR过表达烟草阳性植株茎秆木质部均染成紫红色。相比野生型烟草, 转基因CCR-6号植株木质部着色最深(图9A)。同时, PpCCR反义表达烟草, 转基因株系木质部细胞染色相比野生型染色均变浅, 其中ASCCR-13号株系最为明显(图9B)。
本研究通过构建PpCCR基因正反义载体, 以农杆菌介导的方法转化烟草获得了转基因植株。通过Wiesner染色发现植株的木质素都有不同程度的变化, 其中反义表达烟草AS13株系木质素含量下降幅度最大, 对其表型观察发现茎秆为红褐色, 而其他株系茎秆颜色不明显。在木质素调控的研究中, 常有关于茎秆颜色变化的报道[21, 22, 23], 而关于抑制CCR基因表达使得转基因植株茎秆颜色发生变化在木本植物中常有报道[12, 13], 在草本植物中研究不多。本研究中抑制CCR基因的表达, 仅有一个植株出现红褐色, 是否CCR基因抑制到一定的程度才会出现颜色变化的表型, 而且具体的作用机理还有待研究。Wiesner染色主要是间苯三酚对木质素中的醛类物质特异显色, 并不能准确真实地反映植物木质素总含量的变化[24]。因此, 在下一步试验中可以对转基因植株进行木质素含量的测定。
有研究报道, 在烟草中抑制银合欢(Leucaena leucocephala)CCR基因的表达, 转基因植株生长不正常, 叶片出现卷曲, 延迟开花[12], 但在桉树(Eucalyptus alba)中对CCR基因进行调控, 却不影响植株的生长[11]。本研究中, 转基因烟草生长正常, 可能是不同植株中基因表达的差异造成的。在对木质素合成关键酶基因4CL的研究中发现, 下调拟南芥4CL1和4CL2基因表达量, 木质素下降的同时伴随纤维素含量的提高[25]。在转基因PpCCR植株中, 木质素和纤维素合成中是否存在相互补偿机制还需要进一步研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|