第一作者:赵妗颐(1995-),女,贵州惠水人,在读硕士生,主要从事植物促生菌及生防菌方面的研究。E-mail:zhaojinyi404@foxmail.com
为获得草坪蘑菇圈病原菌拮抗生防菌剂的优化参数,本研究以拮抗蘑菇圈病原-肉褐麟小伞菌( Lepiota brunneo-incarnata)的黄曲霉( Aspergillus flavus) CP01为目的菌,对其分别进行液、固态发酵条件的优化。通过单因素试验优化发酵时间、培养温度、培养基类型及初始pH等条件,对最佳液态发酵条件进行筛选;并通过单因素试验优化培养物料、外源养分、发酵时间和温度等条件,对最佳固态发酵条件进行筛选。结果表明:液体发酵条件下,马铃薯葡萄糖液体培养基(PDB)中菌丝体干重含量最高,而在青秸秆粉浸提液培养基(CSE)中有效菌数最高,且该发酵液对蘑菇圈病原的抑菌效果最佳,培养基最适初始pH为5、最佳发酵条件为30 ℃、5 d;在固态发酵条件下,最适发酵培养物料为经浸提法去营养化的青秸秆粉,外源添加养分为料水比1∶50的青秸秆粉浸提液,最适发酵条件为33 ℃、9 d。以上优化参数为草坪蘑菇圈生防菌剂的研发奠定了基础。
The aim of this study was to optimize the fermentation conditions for obtaining the biological inoculant of an antagonist of the fairy ring mushroom Lepiota brunneoincarnata. Aspergillus flavus CP01 is a pathogen of the fairy ring mushroom, and we optimized its liquid and solid fermentation conditions. We screened for the best liquid fermentation conditions of the antagonist in terms of medium type, fermentation time, temperature, and initial pH using the single-factor method. We also screened for the optimal solid fermentation conditions of the target host fungus, viz., L. brunneoincarnata, in terms of training material and additional nutrition type, fermentation time, and temperature using the single-factor method. Results showed that the optimal growth medium of A. flavus was potato dextrose broth (PDB), which achieved the maximum dry weight of mycelial bead, while the medium type ensuring the maximum number of effective bacteria and the best antibacterial effect was corn stalk leach liquor (CSE) with an optimal initial pH of 5. The optimal liquid fermentation conditions were identified as 30 ℃ and 5 days. The optimal medium type was counteract-eutrophication straw powder by extraction as training material and corn stalk leach liquor at 1∶50 as additional nutrition type for maximum spore yield. The optimal solid fermentation conditions were identified as 33 ℃ and 9 days. These optimized parameters establish a technical basis for the development of an antibiological inoculant of fairy rings.
草坪蘑菇圈(fairy ring)又称仙环病或仙人圈, 是由小伞菌(Lepiota sp.)和马勃属(Lycoperdon spp.)等各类担子菌引起的草坪常见病害之一, 病原菌丝体由中间向四周蔓延, 并辐射状生长形成环状排列的子实体[1]。蘑菇圈病原的生长代谢会引起草地养分的不平衡分布, 甚至造成草坪草植株的早衰或死亡。根据对草坪草的危害程度, 草坪蘑菇圈病原可分为3个类型[2]:1)能造成草坪草死亡或坪用性状严重退化; 2)加速周边草坪草的生长或引起草坪草开花, 提前完成生活史; 3)对草坪草的生长没有明显影响。当观赏性草坪或实用性草坪(如高尔夫球场、运动场草坪等)发生第1或第2种草坪蘑菇圈时, 会造成草坪草长势不均、早衰或死亡, 使草坪质量下降甚至建坪失败[2]。
现阶段草坪蘑菇圈的防治主要依赖化学药物的熏蒸或喷施[3], 前者是解决土壤问题最直接、有效的途径, 但其毒性较高、操作繁琐[4, 5]; 而后者使用便捷、防治效果显著, 但也存在药剂污染、毒害人畜及有益昆虫、破环草坪微环境生态平衡等问题[6]。近年来, 生物防治成为草坪病害防控的重点发展方向, 有研究表明利用无致病性的Phialophra graminicola可控制剪股颖(Agrostis stolonifera)全蚀病的蔓延[7]。目前一些草坪真菌病害的生防制剂在草坪有害生物综合防治中具有良好的应用前景[8, 9, 10], 而针对草坪蘑菇圈病害的防治, 国内外仍以化学药剂为主, 但相关专用生防菌剂并不多见。研究者认为木霉菌能有效拮抗担子菌类真菌[11, 12]。姬承东与李剑峰[13]发现某些木霉菌及其代谢物对蘑菇圈真菌能产生明显的抑制作用, 且用于制备高效拮抗菌剂具有广阔的市场潜力, 但对有关草坪蘑菇圈生防菌剂的发酵条件研究鲜有报道。鉴于发酵工艺参数是植物促生菌及生防菌剂发酵生产的技术基础[14], 并且液态发酵的生长速度快、成本低、产量高, 而固态发酵具有设备构造简单、投资少、能耗低, 后处理简便、污染少, 废弃物排放少的特点[15, 16], 本研究以对草坪蘑菇圈原菌有良好拮抗作用的一株黄曲霉(Aspergillus flavus)菌株CP01为研究对象, 对其液态发酵过程中的培养基类型、发酵培养时间、温度和初始pH等条件参数进行比较和分析, 以获得该拮抗菌的最适液态发酵条件; 同时通过对固态发酵中培养物料、外源养分类型、培养时间和培养温度等条件进行单因素试验, 获得拮抗菌固态发酵的最适条件, 为草坪蘑菇圈生防菌剂的研发奠定工艺参数和技术基础。
1.1.1 试验菌种 供试拮抗菌CP01由贵州师范学院喀斯特生境土壤与环境修复研究所提供, 其初始菌株从正常废弃平菇栽培菌包中分离纯化获得, 2016年10月以通用引物ITS1/ITS4扩增片段进行ITS序列测定, 鉴定为黄曲霉(Aspergillus flavus)。
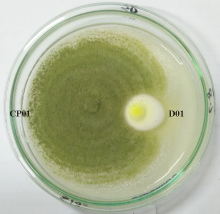
供试的蘑菇圈病原菌D01采集自贵阳市乌当区东南部(25° 59'31.05″ N, 109° ° 04'08.40″ E)贵州师范学院湖畔的狗牙根草坪蘑菇圈上, 发病样地海拔1 242 m, 属亚热带季风湿润气候, 年均降水量1 179.8~1 271 mm。经通用引物ITS1/ITS4扩增片段进行ITS序列测定, 鉴定为肉褐麟小伞菌(Lepiota brunneo-incarnata)(图1)。
1.1.2 培养基配制 马铃薯葡萄糖液体培养基(PDB)[17]:马铃薯200 g, 葡萄糖20 g, 水1 000 mL, pH 7, 121 ℃湿热灭菌20 min。
察氏培养基[18]:NaNO3 2 g, K2HPO4 1 g, MgSO4· 7H2O 0.5 g, KCl 0.5 g, FeSO4 0.01 g, 蔗糖30 g, 蒸馏水1 000 mL, pH为7, 121 ℃湿热灭菌20 min。
青秸秆粉浸提液培养基(CSE)[19]:料水比为1∶ 50的青秸秆粉浸提液培养基(CSE 1∶ 50), 121 ℃湿热灭菌25 min后避光保存。1∶ 100 CSE培养基配制时取原液稀释一倍, 使用时各添加甘露醇10.0 g· L-1配制成液体发酵培养基。
马铃薯葡萄糖固体培养基(PDA)分为两种。
PDA培养基Ⅰ :马铃薯200 g, 葡萄糖20 g, 琼脂15~20 g, 水1 000 mL, pH 7, 121 ℃湿热灭菌20 min。
PDA培养基Ⅱ :马铃薯200 g, 葡萄糖20 g, 琼脂11.5 g, 水1 000 mL, pH 7, 121 ℃湿热灭菌20 min。
固体培养物料[20]:培养物料选择青秸秆粉、去营养化青秸秆[21](即秸秆粉滤渣经蒸馏水洗涤2~3遍后80 ℃烘干)[19]、废弃食用菌栽培基质[22](即将正常废弃食用菌栽培菌袋内的发酵物料捏碎、混匀, 80 ℃烘箱12 h烘干, 以下简称基质)。
固体培养物料的外源养分设置为马铃薯培养液、CSE 1∶ 50与CSE 1∶ 100青秸秆粉浸提培养液、空白培养液。马铃薯、CSE 1∶ 50与CSE 1∶ 100青秸秆粉浸提培养液、甘露醇的添加量各为培养基总质量的1%, 固体培养物料的初始水含量为35%。土豆、CSE浸提液提供氮素、磷素、微量元素, 甘露醇提供碳源物质。
马铃薯培养液:将0.73 g去皮马铃薯加入到40 mL蒸馏水中煮沸5~10 min, 用纱布过滤后定容至40 mL, 再加入0.73 g甘露醇充分搅拌均匀。
CSE 1∶ 50青秸秆粉浸提培养液:在40 mL蒸馏水中加入0.75 mL CSE 1∶ 50原液, 再加入0.75 g甘露醇(配置CSE 1∶ 100青秸秆粉浸提培养液与此相同)。
空白培养液:在40 mL蒸馏水中加入0.74 g甘露醇。
根据试验设计在每称取的10 g培养物料中加入5.5 mL马铃薯培养液或5.3 mL CSE 1∶ 50、CSE 1∶ 100青秸秆粉浸提培养液或5.4 mL空白培养液, 混合均匀后制成初始含水量为35%的固体培养物料, 并将各培养物料装入锥形瓶内121 ℃湿热灭菌1 h。
1.2.1 液态摇瓶发酵单因素试验 拮抗菌黄曲霉液态发酵采用250 mL锥形瓶, 每瓶装液量为100 mL培养基, 接种量为一个直径0.4 cm的菌饼, 150 r· min-1摇床震荡培养, 并设置不同的培养基类型、培养时间/d、温度/℃、初始pH 4个指标进行单因素试验[23, 24]。以发酵产物的菌丝体干重、发酵液活菌数、活菌抑菌效果为指标, 确定拮抗菌黄曲霉菌株的最佳液态发酵条件。
单因素试验设置:在温度为28 ℃下培养4 d, 设置初始pH为7的不同发酵培养基(马铃薯葡萄糖液体培养基、察氏培养基、青秸秆粉浸提液1∶ 50及1∶ 100培养基); 保持培养温度为28 ℃、初始pH为7的马铃薯葡萄糖液体培养基, 控制不同的培养时间(3、4、5、6 d); 保持培养时间为4 d、初始pH为7的马铃薯葡萄糖液体培养基, 控制不同的培养温度(18、20、23、25、28、30 ℃); 保持培养时间为4 d、培养温度为28 ℃, 设置马铃薯葡萄糖液体培养基不同初始pH(5、6、7、8、9)。试验均采用1 mol· L-1的HCl和NaOH调节pH, 每个处理设3个重复。
1.2.2 发酵液活菌数及菌丝球干重的测定 用无菌纱布过滤发酵物, 获得发酵液和菌丝球, 再用蒸馏水洗涤菌丝球两次后烘干称其干重。将发酵液稀释至10-2、10-3、10-4倍, 取0.2 mL稀释液用平板计数法测其每毫升菌液含菌量(CFU· mL-1), 每个浓度梯度设3个重复。
每毫升菌液含菌量(CFU)= 同一稀释度3次重复的菌落平均数× 稀释倍数× 5。
1.2.3 发酵液特性的检测 根据牛津杯法测发酵液抑菌活性[18, 25]。即在内径为9 cm的无菌培养皿中加入已灭菌的PDA培养基Ⅰ 15 mL, 摇匀, 置于水平位置使其凝固, 作为底层, 另取5 mL无菌离心管分别加入0.2 mL病原指示菌(即发酵4 d的蘑菇圈病原D01发酵液)和3.8 mL冷却至48~50 ℃的PDA培养基Ⅱ , 迅速摇匀后加入到已凝固的培养基Ⅰ 平板中, 使其在顶层均匀分布, 凝固后分别在每个双层平板中呈三角位置放置3个无菌牛津杯备用。测发酵液抑菌活性时分别在3个牛津杯中加入0.2 mL拮抗菌活菌发酵液, 28 ℃恒温培养箱培养2 d后移去牛津杯, 精确测量各菌落的直径。
1.3.1 固态发酵单因素试验 以测拮抗菌黄曲霉菌株发酵产物的活菌数为指标, 分别对不同培养物料与外源养分的组合类型、培养时间、培养温度进行单因素试验, 从而确定拮抗菌最佳固态发酵条件。在选择培养物料类型及外源养分种类时试验设置6个处理, 即在基质与去营养化青秸秆粉内分别添加马铃薯培养液、CSE 1∶ 50、CSE 1:100青秸秆粉浸提培养液, 以添加空白培养液的无菌物料为对照, 并以添加空白培养液的青秸秆粉作为待选物料, 28 ℃恒温培养拮抗菌黄曲霉7 d后测其活菌含量; 在培养温度为28 ℃、固体培养物料为基质与CSE 1:50的组合中, 控制拮抗菌的培养时间设置为5、6、7、8、9 d; 在固体培养物料为基质与CSE 1∶ 50的组合中培养拮抗菌7 d, 控制拮抗菌的培养温度设置为25、27、30、33、35 ℃。每个处理设3个重复。
1.3.2 活菌含量的测定 将发酵后的培养产物混匀后称取0.2 g加入1.8 mL无菌磷酸缓冲液(PBS), 旋涡振荡器振荡20 s, 洗涤培养物, 回收洗涤液, 并稀释洗涤液, 用平板菌落计数法测量其活菌含量(CFU· g-1)。
以Excel 2003软件整理数据, 采用SPSS 19.0软件对所测数据进行单因素统计分析, 并用Duncan法对各测定数据进行显著性检验(P< 0.05)。
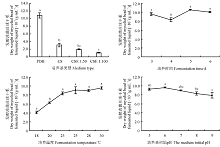
2.1.1 不同发酵条件对拮抗菌发酵液菌丝体干重的影响 在PDB培养基中, 拮抗菌发酵液中菌丝体干重达到最大值, 为10.78× 10-3 g· mL-1, 察氏培养基次之, CSE培养基最低(图2)。且察氏培养基、CSE 1∶ 50培养基和CSE 1∶ 100培养基分别为PDB培养液的28.59%、18.09%和9.97%。PDB培养基与察氏培养基和CSE培养基均差异显著 (P< 0.05)。
拮抗菌培养4 d时菌丝体干重显著低于培养3、5和6 d (P< 0.05) (图2)。在培养5 d时拮抗菌发酵液中菌丝体干重达到最大值, 为10.54× 10-3 g· mL-1, 分别是培养3、4和6 d的109.92%、126.90%和104.98%。并且在培养6 d时拮抗菌发酵液中菌丝体干重较5 d的少, 与培养3 和5 d的差异不显著(P> 0.05)。
随着培养温度的升高, 发酵液中菌丝体干重呈逐渐上升趋势(图2)。以培养温度为横坐标(x)、菌丝球干重为纵坐标(y)进行相关性分析, 得到回归方程为y=3.164 4 ln(x)+4.276 5, 相关系数R2=0.965 3。并在30 ℃时拮抗菌发酵液中菌丝体干重达到最高值, 为9.61× 10-3 g· mL-1, 但与培养温度为23、25和28 ℃时菌丝体干重差异不显著(P> 0.05)。而培养温度为18 ℃时, 拮抗菌发酵液中菌丝体干重降到最小值为4.09× 10-3 g· mL-1, 分别为20、23、25、28和30 ℃的 64.81%、48.93%、45.09%、45.11%和42.52%。
拮抗菌在培养基初始pH为6时, 发酵液中菌丝体干重达到最大值, 为9.63× 10-3 g· mL-1, 但在该pH下与培养基初始pH为5和7时均差异不显著(P> 0.05)(图2)。以培养基初始pH为横坐标(x)、菌丝球干重为纵坐标(y)进行相关性分析, 得到回归方程为y=-0.105 2x2+0.219 1x+9.309 4, 相关系数R2=0.914 7。在培养基初始pH为7、8、9时, 其发酵液菌丝体干重之间差异并不显著, 且随着培养基初始pH升高而降低。
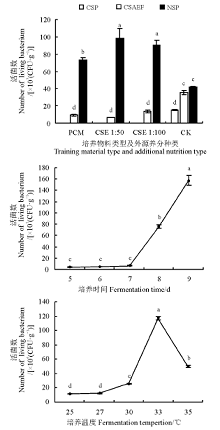
2.1.2 不同发酵条件对拮抗菌发酵液活菌数的影响 拮抗菌在CSE培养基中的活菌数最多, PDB培养基次之、察氏培养基最低(图3)。即在CSE 1∶ 50培养基中活菌数为3.52× 106 CFU· mL-1, 分别为PDB培养基与察氏培养基的22.71和1 760.5倍, 且差异显著(P< 0.05)。而在CSE 1∶ 100培养基中活菌数为5.76× 105 CFU· mL-1, 分别为PDB培养液与察氏培养基的3.77和288倍 。并且以PDB为拮抗菌培养基时, 其发酵液中的活菌数分别与察氏培养基和CSE 1∶ 100培养基差异不显著(P> 0.05), 但察氏培养基与CSE培养基差异显著(P< 0.05), 分别为CSE 1∶ 50培养基的0.06%、CSE 1∶ 100培养基的0.35%。
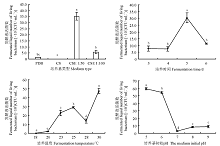 | 图3 不同培养基类型、培养时间、培养温度及培养基初始pH对发酵液活菌数的影响Fig. 3 Influences of medium type, fermentation time, fermentation temperature, and initial medium pH on number of living bacteria in fermented liquid |
在培养5 d时, 拮抗菌发酵液中活菌数最高, 为3.04× 105 CFU· mL-1, 与培养3、4、6 d的差异均显著(P< 0.05)。但培养3、4、6 d后发酵液活菌数之间差异不显著(P> 0.05), 分别为培养5 d的25.91%、24.95%、37.76%(图3)。
在培养温度为30 ℃时, 拮抗菌发酵液活菌数最高, 为4.74× 105 CFU· mL-1(图3); 在培养温度为18 ℃时, 活菌数最低, 为14.2 CFU· mL-1。并且在培养温度为28 ℃时, 拮抗菌发酵液中活菌数与18、20、23、25、30 ℃之间均差异显著(P< 0.05), 为30 ℃培养处理的29.04%。
拮抗菌在培养基初始pH为7时活菌数最低, 为2.75× 103 CFU· mL-1, 而在培养基初始pH为5时拮抗菌发酵液活菌数最高, 为pH是7处理的2 157.82%(图3)。并且发酵液活菌数在培养基初始pH为8和9时有上升趋势, 增长率分别为pH是7处理的200%和226.55%。
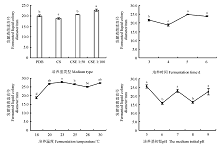
2.1.3 不同发酵条件对拮抗菌发酵液活菌抑菌效果的影响 拮抗菌发酵液中活菌抑菌效果最佳的培养基为CSE, 在CSE 1∶ 100和CSE 1∶ 50培养基上菌落直径为22.75和20.54 mm, 分别为PDB培养液与察氏培养基的1.03、1.09倍及1.17、1.21倍(图4)。并且PDB、CSE 1∶ 50、CSE 1∶ 100培养基分别与察氏培养基活菌抑菌效果差异显著(P< 0.05), 分别为察氏培养基的106.43%、109.20%和120.95%。
培养5 d拮抗菌发酵液中活菌抑菌效果最佳, 菌落直径为24.86 mm(图4)。而培养6 d拮抗菌的抑菌效果有减弱趋势, 但与5 d时的差异并不显著(P> 0.05)。且在培养3、5、6 d时发酵液的活菌抑菌效果与培养4 d时的差异显著(P< 0.05), 分别4 d的114.95%、131.81%和126.67%。
培养温度为23 ℃时, 发酵液活菌抑菌效果最佳, 菌落直径为27.98 mm, 与培养温度为20、30 ℃时发酵液活菌抑菌效果差异并不显著(P> 0.05)(图4)。在培养温度为18 ℃时, 其发酵液活菌抑菌效果最低, 且与20、23、25、28和30 ℃处理下差异显著(P< 0.05), 分别为上述温度的69.81%、66.87%、70.55%、74.60%和68.61%。
培养基初始pH为5时发酵液活菌抑菌效果最佳, 菌落直径为25.58 mm, 与培养基初始pH为7和9时发酵液活菌抑菌效果差异不显著(图4)。并且在培养基初始pH为6和8时, 发酵液活菌抑菌效果差异显著, 分别为培养基初始pH为5时的61.61%、63.60%。
2.2.1 不同发酵条件下对活菌数的影响 在固态培养物料为去营养化秸秆粉、外源养分为CSE 1∶ 50时活菌数达到最高, 为9.84× 108 CFU· g-1(图5); 在以废弃的食用菌栽培基质为培养物料时活菌数达到最高, 为3.55× 108 CFU· g-1, 但仅为前者的37.18%; 而在以不添加外源养分的青秸秆粉为培养基时拮抗菌活菌数与培养物料为去营养化秸秆粉、外源养分为CSE 1∶ 50的组合类型差异显著(P< 0.05), 为后者的15.49%。
随着培养时间的延长, 固态培养物料中拮抗菌活菌数逐渐上升, 在培养9 d时活菌数达到最大, 为1.58× 107 CFU· g-1(图5)。以培养时间为横坐标(x)、活菌数为纵坐标(y)进行相关性分析, 得到回归方程y=16.475x2-60.983x+51.497, 决定系数R2=0.988 4。在培养5、6、7 d时, 拮抗菌的活菌数差异不显著, 分别为培养9 d的2.60%、2.89%、4.27%。
拮抗菌在25、27、30、33、35 ℃下的活菌数呈单峰曲线变化, 即在培养温度为33 ℃时活菌数达到最大值, 为1.17× 108 CFU· g-1, 而随温度降低和升高拮抗菌活菌数逐渐降低(图5); 且在培养温度为25 ℃时活菌数降到最低, 为1.17× 107 CFU· g-1。
目前, 已有研究者将黄曲霉制成的菌悬浮液用于防治苹小卷叶蛾(Adoxophyes orana beijingensis)[26], 可见黄曲霉已用作害虫生防菌剂, 但鲜见用于草坪蘑菇圈等真菌病害防治方面的报道。本研究对拮抗菌黄曲霉(Aspergillus flavus)菌株CP01进行液、固态发酵条件的优化, 可为草坪蘑菇圈生防菌剂的研发奠定工艺基础和技术方向。
CSE培养基中含有大量比例均衡的可溶性氮、磷、糖及微量元素, 可为微生物的生长繁殖提供可直接利用的营养[19], 并且用CSE培养基培养拮抗菌时, 其发酵液中具有最大活菌数和最佳活菌抑菌效果, 同时CSE培养基价格低廉, 符合生产实际需要[27]; 而察氏培养基虽成分精确, 但不适合拮抗菌Aspergillus flavus CP01的发酵。综上所述, CSE培养基可作为拮抗菌黄曲霉菌株液体发酵的最适培养基, 且在今后对其他菌株进行发酵也可考虑CSE培养基。
本研究在观察拮抗菌黄曲霉的发酵过程发现, 培养前期拮抗菌发酵液中菌体为白色, 随着培养时间的延长, 发酵液与锥形瓶壁接触的菌体由白色生长为绿色。在发酵培养至第5天时, 拮抗菌发酵液中的菌丝球质量、活菌数、活菌抑菌效果达到最高。但在本研究中, 拮抗菌培养至第4天时出现了一个生长下降点, 这可能是该拮抗菌生长特性所致, 而在第6天生长下降则有可能是由养分浓度有关[28]。并且拮抗菌黄曲霉菌株很可能对蘑菇圈病原菌的抑制作用是通过菌丝的快速生长或者产生孢子的方式而进行基质竞争抑制[29]。
温度是影响拮抗菌发酵的重要因素, 贺亮等[30]研究表明高温高湿是影响真菌生长的重要原因。在本研究中培养温度为18 ℃时, 拮抗菌黄曲霉发酵液中菌丝球含量显著低于各个处理; 而当培养温度为30 ℃时, 拮抗菌黄曲霉发酵液中菌丝球含量与活菌数达到最大值, 此外拮抗菌发酵液活菌抑菌效果最佳的培养温度却为23 ℃, 但与培养温度为20 ℃、30 ℃的发酵液活菌抑菌效果差异不显著, 所以可将拮抗菌黄曲霉最佳培养温度确定为30 ℃, 并且庄振宏等[31]分析也发现, 在30 ℃时黄曲霉生长最为迅速, 这与本研究结果一致。
拮抗菌在培养基初始pH为5和6时菌丝球含量并不显著, 观察其拮抗菌发酵液可发现, 培养基初始pH越接近中性时, 发酵液中菌丝球体积越小、密度越大。综合分析可知, 拮抗菌黄曲霉在培养基初始pH为5时, 拮抗菌发酵液中菌丝球含量、活菌数、发酵液活菌抑菌效果均达到最佳, 则可能是弱酸性环境有利于拮抗菌黄曲霉发酵。据报道, 黄曲霉毒素B1易被亚硫酸钠、氢氧化钠等碱性试剂脱除[32], 因此与本研究结果基本吻合。
本研究通过单因素筛选拮抗菌固态发酵条件得知, 培养物料及外源养分种类、培养温度以及培养时间是影响拮抗菌活菌数的重要因素。而快速筛选培养基有效成分及确定各成分之间的优化组合是菌株发酵培养条件筛选的关键步骤[33], 其中, 培养物料为去营养化秸秆粉、外源养分为1:50秸秆粉浸提液的培养基组合是获得拮抗菌最大活菌数的最佳培养基组合; 并且拮抗菌最佳培养温度为33 ℃, 在此温度条件下, 接种的拮抗菌孢子可以迅速萌发产生大量的菌丝体, 进而可以生成大量的孢子; 在固态发酵时, 拮抗菌培养至9 d时可以达到最大的活菌数, 观察其发酵过程可以发现, 在培养前期时, 拮抗菌发酵产物中菌丝为白色, 随着培养时间的增加, 拮抗菌由白色菌丝生长为绿色孢子。
1)液态发酵中最适合拮抗菌黄曲霉菌株CP01生长的最适培养基是青秸秆粉浸提液培养基, 目标菌活菌含量与抑菌效果较PDB培养基分别显著高出2 271%和112.62%, 并且拮抗菌最佳的培养时间为5 d、培养温度为30 ℃、培养基初始pH为5。
2)固态发酵中培养物料为去营养化秸秆粉、外源养分为1∶ 50秸秆粉浸提液培养液是拮抗菌黄曲霉菌株CP01生长最佳的培养基组合类型, 且该拮抗菌最佳的培养温度为33 ℃、培养时间为9 d。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|