第一作者:贾美清(1978-),女,山西偏关人,实验师,硕士,研究方向为土壤生态。E-mail:jiameiqing@mail.nankai.edu.cn
为了探讨气候变化对荒漠草原土壤真菌群落结构和多样性的影响,进而更有效地管理草原,在内蒙古短花针茅( Stipa breviflora)荒漠草原进行远红外线辐射器模拟增温和人工施肥模拟增氮试验。经过6年的连续模拟试验后,采用稀释平板涂布法结合18S rRNA分子鉴定技术,对试验地土壤可培养真菌群落的组成和多样性进行分析。结果表明,1)从内蒙古短花针茅荒漠草原土壤中共分离获得17个属的可培养真菌;2)模拟增氮不增温、增温增氮处理均使可培养真菌的菌落数显著增加( P<0.05),分别由不增氮不增温的菌落数6.70×105 CFU·g-1升高到1.45×106和1.92×106 CFU·g-1,但二者间差异不显著 ( P>0.05);3)增氮不增温、增温增氮处理的群落组成和优势属发生了改变,在增氮不增温处理中的优势菌属为镰刀菌属( Fusarium)、交链孢霉属( Alternaria)和假裸囊菌属( Pseudogymnoascus);增温增氮处理的优势菌属为青霉属( Penicillium)和曲霉属( Aspergillus)、镰刀菌属、交链孢霉属和 Chromocleista;4)与其它两个处理相比,增氮不增温处理显著提高了荒漠草原可培养真菌的物种丰富度、均匀度和多样性。增温增氮对群落内物种丰富度、均匀度和多样性均没有显著影响。
To understand how to effectively manage a desert steppe environment during a period of warming and nitrogen deposition, the effects of nitrogen (N) addition and warming on the community structure and diversity of cultivatable fungi were studied. The dilution plate method was used together with the molecular analysis of 18S rRNA after the application of infrared radiation to simulate global warming and fungi were artificially fertilised for 6 years in a desert steppe with the dominant species of Stipa breviflora in Inner Mongolia. The results indicated that 17 fungal genera were isolated from the desert soil. N addition alone or with simulated warming led to a significant ( P<0.05) increase in the total number of cultivatable fungi from 6.70×105 colony-forming units·g-1 in the untreated control to 1.45×106 or 1.92×106 colony-forming units·g-1, respectively. Moreover, the community composition and dominant species changed with N addition. With N addition alone, the dominant fungal genera Aspergillus, Hypocrea, and Cladosporium were replaced by Fusarium, Alternaria, and Pseudogymnoascus, and the species richness, evenness, and diversity significantly increased. The effect of N addition with simulated warming increased the abundance of the dominant fungal genera Penicillium and Aspergillus, and another three dominant fungal genera were replaced by Fusarium, Alternaria, and Chromocleista. Combining N addition with simulated warming had no significant effects on the species richness, evenness, and diversity of cultivable fungi, compared with N addition alone.
在20世纪内, 全球气温已经上升了0.6 ℃[1], 并预计到21世纪末全球平均地表温度将继续升高1.6~6.4 ℃, 且在高纬度或高海拔地区的增温幅度更为明显[2]。同时, 由于化石燃料的燃烧、含氮化肥的使用使得输入到生态系统中的氮素含量大大增加, 在未来25年内大气氮沉降水平预计还会加倍[3], 大气氮沉降的增加已成为全球变化的重要现象之一[4]。
在全球气候变暖的背景下, 我国草原区的气候近50年明显变暖[5]。由于气候变化加之人为干扰, 约90%的草原出现了不同程度的退化[6]。Galloway等[7]报道, 中国氮沉降水平已高达1.2 g· (m2· a)-1, 是世界三大高氮沉降区之一。目前, 内蒙古草原生态系统的氮沉降水平为0.4~0.6 g· (m2· a)-1, 但随着经济的快速发展, 化肥和化石燃料使用量的大幅增加, 其沉降量必将增加[8]。内蒙古草原天然草地面积占全国草地的1/4, 覆盖了内蒙古自治区土地面积的67.5%[9]。荒漠草原是内蒙古草原的重要组成部分, 位于草原向荒漠的过渡带, 是对环境的变化较敏感的草原生态类型[10]。气候变暖和氮沉降是内蒙古草原面临的重要环境问题。
土壤微生物是草原生态系统的重要组成部分, 其中真菌群落在微生物群落中占有非常重要的地位。在草地生态系统中, 真菌占分解者生物量总体的78%~90%[11], 是生态系统健康状况的指示者。气候变化和人为干扰对草地生态系统的土壤真菌多样性的影响越来越受到科技工作者的重视。目前, 关于气候变化对荒漠草原生态系统的研究主要关注点集中在气候变化对植被和群落组成[6, 12]、土壤呼吸[13]和土壤特性[14]、植物物种多样性[12]等方面。对于草原土壤真菌对气候变化响应方面的研究也取得了一些成果[15, 16], 然而, 对草甸草原的研究居多而荒漠草原甚少[17]。因此, 加强气候变化对荒漠草原土壤真菌群落结构和多样性影响的研究对于实现草原的有效管理和可持续利用具有重要意义。本研究通过稀释平板涂布法和18S rRNA分子鉴定技术, 探讨连续6年远红外线辐射器模拟增温、人工施肥模拟氮沉降对短花针茅(Stipa breviflora)荒漠草原土壤可培养真菌的群落结构和多样性的影响, 以期为荒漠草原对全球变暖和氮沉降的响应机制的进一步研究提供基础数据, 并为荒漠草原的有效管理提供参考。
试验区位于内蒙古自治区乌兰察布市四子王旗王府一队的内蒙古农牧科学院实验基地内, 属于荒漠草原类型, 地理坐标为41° 47'17″ N, 111° 53'46″ E, 海拔1 456 m。年均气温4 ℃, 多年平均降水量280 mm, 年均蒸发量2 947 mm。年平均日照时数为3 082.5 h, ≥ 10 ℃的年积温为2 200~2 500 ℃· d。试验地建群种为短花针茅。
2006年5月选取地形平坦, 植被典型的试验样地架设模拟增温装置。本试验设不增氮不增温、增氮不增温、不增氮增温和增温增氮4个处理, 各6次重复, 采用双因素完全随机区组裂区设计。12个试验区 (3 m × 4 m), 其中的6个区进行增温处理, 另外6个区不进行增温处理, 各试验区随机分布, 试验区间设置了3 m× 3 m的缓冲带以避免干扰。对每个试验区的一半进行施氮处理, 另一半不进行施氮处理, 在施氮和不施氮之间有30 cm深的物理隔离, 共24个小区。在增温区的中央部位距地面2.25 m高度处安装一台功率为2 000 W红外辐射模拟加热器, 不间断地进行加热处理, 而在不增温小区距地2.25 m处安装1台与模拟加热器大小相同铁皮制的“ 假灯” , 用来模拟加热装置的阴影效果, 以降低误差。施氮处理采用氮肥NH4NO3, 施用量为10 g· (m2· a)-1, 每年6月-7月雨季时进行。本研究对增氮不增温(N1W0)、不增氮不增温(N0W0)、增温增氮(N1W1)3个处理进行分析研究。
经过连续6年的增温和增氮试验后, 于2012年8月初每个小区随机选择取样点, 用直径5 cm的土钻采集0-10、10-20、20-30 cm土层的土样。将所取土样各层分别充分混匀后分成两份, 分装在塑料封口袋中密封, 低温4 ℃下带回实验室。其中一份用于测定土壤含水量, 另一份置于冰箱中-20 ℃条件下冷冻保存备用。
1.3.1 土壤可培养真菌的分离培养 制备马丁氏培养基[18]对土壤真菌进行培养。取1 g充分混匀后的土壤样品于装有100 mL无菌水的三角瓶中, 150 r· min-1震荡20 min。取此浓度的土壤悬液0.2 mL, 用无菌涂布器均匀涂布到直径90 mm的平板上, 同一样品分别设置3个重复。将平板倒置在28 ℃的恒温培养箱中培养5~7 d, 待菌落长出后参考鉴定手册[19, 20, 21, 22]进行初步鉴定并根据菌落特征来分类、编号, 进行菌落计数。最后挑选不同菌种的生长良好的代表性菌落进行分离、纯化, 以备后续的分子鉴定用。
1.3.2 可培养真菌18S rRNA的PCR扩增 首先利用试剂盒(上海生工)提取将用于后续试验待鉴定的真菌的DNA, 然后进行PCR扩增。
扩增引物:GeoA2:5'-CCAGTAGTCATATGCTTGTCTC-3'和Geo11:5'-ACCTTGTTACGACTTTTACTTCC-3'。PCR的反应体系为50 μL:10× Ex Buffer(含Mg2+) 5 μL, dNTP(各2.5 mmol· L-1) 4 μL, 上游和下游引物各2 μL, Tap Ex DNA聚合酶0.5 μL (5 U· μL-1), 模板1 μL(10 ng· μL-1), 加超纯水至50 μL。PCR反应程序: 94 ℃预变性4 min; 变性94 ℃ 1 min, 30次循环; 退火54 ℃ 1 min; 延伸72 ℃ 2 min ; 最后72 ℃下延伸7 min; 温度下降到4 ℃。扩增后的PCR产物采用琼脂糖凝胶(1.5%)电泳25 min后, 根据示踪染料位置可停止电泳, 然后进行EB染色4 min, 最后冲洗凝胶并进行凝胶成像, 在计算机上观察成像结果, 拍照分析。
1.3.3 土壤可培养真菌的分子鉴定 将上述真菌18S rRNA电泳检测出条带的PCR产物送交北京六合华大基因科技股份有限公司进行测序。将测序后的序列在GenBank 数据库( http:// www. ncbi. nlm. nih. gov) 里进行比对, 下载最相似的基因序列进行系统发育分析。
采用Excel 2007进行数据录入, 使用SPSS13.0软件对统计数据进行方差分析, 采用Sigmaplot12.5软件进行数据的图表处理; 运用Bio-dap软件来计算多样性指数。
土壤微生物物种多样性指数采用如下公式计算:
物种丰富度指数(S)
S=Ni(1)
式中:Ni为每一个样点所分离出的全部种属的数目, 所以S即为种数;
物种多样性指数(H')
H'=-
Pi=ni/N
式中:Pi为第i种的个体的比例, ni是第i种的菌株数, N是所有菌株数总和;
均匀度指数(E)
E=H'/Hmax (3)
Hmax=lnS(4)
式中:H'为实际观察的物种多样性指数, Hmax为最大的物种多样性指数, S为群落中的总物种数;
检出率=某一物种的个体数/样点中所有物种的个体数× 100% (5)
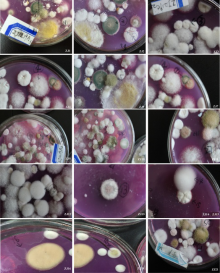
根据鉴定手册[19, 20, 21, 22]并结合18S rRNA基因序列的分子生物学分析 (图1、表1), 共分离到17个属的可培养真菌:青霉属(Penicillium)、曲霉属(Aspergillus)、镰刀菌属(Fusarium)、赤霉属(Gibberella)、交链孢霉属(Alternaria)、Paraconiothyrium、肉座菌属(Hypocrea)、Paraphaeosphaeria、犁头霉属(Absidia)、弯孢属(Curvularia)、枝孢霉属(Cladosporium)、疣瓶孢属(Eladia)、正青霉属(Eupenicillium)、暗球腔菌属(Phaeosphaeria)、假裸囊菌属(Pseudogymnoascus)、爪甲团囊菌科Auxarthron和Chromocleista。另外, 还有因测序失败而无法确定种属关系的9种真菌归为未知菌, 分别为ZJ6、ZJ9、ZJ17、ZJ29、ZJ35、ZJ55和ZJ62。在已分离鉴定的真菌中, 以青霉属真菌种居多, 共11种, 分别为ZJ2、ZJ3、ZJ12、ZJ15、ZJ22、ZJ23、ZJ25、ZJ26、ZJ31、ZJ34和ZJ64。其次, 可培养真菌ZJ4、ZJ11、ZJ18和ZJ21属于镰刀菌属; ZJ7、ZJ16和ZJ41属于曲霉属。其余的属均只分离到1种真菌, 分别是ZJ63为Chromocleista、ZJ58为Auxarthron、ZJ59为假裸囊菌属、ZJ51为暗球腔菌属、ZJ46为正青霉属、ZJ38为枝孢霉属、ZJ33为疣瓶孢属、ZJ28为弯孢属、ZJ14为犁头霉属的、ZJ13为Paraphaeosphaeria、ZJ1为肉座菌属、ZJ10为赤霉属、ZJ8为Paraconiothyrium以及ZJ5为交链孢霉属。除ZJ14外, 所有分离鉴定的真菌与基因库中最相似的菌种的相似性均> 97%。因此, ZJ14为犁头霉属的潜在新种。
续图1 分离鉴定的可培养真菌的形态特征
Continued Fig. 1 Morphological character of isolated and identified fungi strains
| 表1 可培养真菌菌株18S rRNA基因序列分析结果 Table 1 Results of 18S rRNA gene sequences of fungi strain isolated from soil sample |
不增氮不增温和增氮不增温处理中, 可培养真菌的总种数相同, 均有15种, 但是组成发生了变化, 增氮增温处理中共14种(表2)。与不增氮不增温处理相比, 增氮不增温处理中新出现了3种可培养真菌, 分别是Paraconiothyrium、Paraphaeosphaeria和暗球腔菌属, 并且3种新出现的真菌检出率均≤ 1%。与此同时, 犁头霉属、枝孢霉属和Chromocleista 3种可培养真菌在经增氮处理后消失。其中枝孢霉属真菌在不增氮不增温处理中的检出率为6.97%, 其余两种的检出率均为0.48%。与不增氮不增温组相比, 增氮增温处理中出现Paraconiothyrium菌和Paraphaeosphaeria, 弯孢属、枝孢霉属和未知菌消失。与增氮不增温组相比, 增温增氮组出现犁头霉属和Chromocleista, 弯孢属、暗球腔菌属和未知菌消失。
增氮不增温和增温增氮处理显著提高了荒漠草原可培养真菌的菌落数量(表2)。不增氮不增温0-30 cm土层的可培养真菌的菌落总数为6.70× 105 CFU· g-1, 与其相比, 增氮不增温处理显著增加到1.45× 106 CFU· g-1(P< 0.05), 增温增氮显著增加到1.92× 106 CFU· g-1, 但是二者间的菌落数差异不显著(P> 0.05)。不增氮不增温处理的优势菌属为青霉属(49.75%)、曲霉属(10.45%)、肉座菌属(7.46%)、疣瓶孢属(6.97%)、枝孢霉属(6.97%)。增氮不增温处理后的优势菌属为青霉属(35.73%)、镰刀菌属(22.35%)、交链孢霉属(13.59%)、假裸囊菌属(8.52%)和疣瓶孢属(7.38%), 其镰刀菌属、交链孢霉属、疣瓶孢属、假裸囊菌属、Auxarthron和未知菌的检出率升高, 青霉属、曲霉属、肉座菌属、弯孢属、正青霉属的检出率降低, 赤霉属和疣瓶孢属两个属真菌的检出率变化不大。分析发现, 经增氮处理后5个优势菌属中有3个被替代, 青霉属虽然还是优势菌属, 但是检出率较对照有所降低, 只有疣瓶孢属真菌的检出率没有明显变化。
与不增氮不增温处理相比, 增温增氮处理中, 肉座菌属、疣瓶孢属的检出率降低, 青霉属和犁头霉属的检出率没有变化, 其它菌属的检出率均升高(表2)。优势菌属的组成和数量也发生了变化, 青霉属\曲霉属的检出率升高、镰刀菌属、交链孢霉属和Chromocleista是不增氮不增温处理中新的优势菌。
| 表2 不同处理间0-30 cm土层可培养真菌群落组成及数量 Table 2 Community composition and quantity of fungi at 0-30 cm soil depth among different treatments |
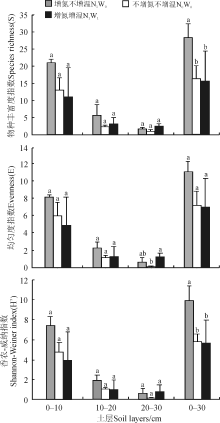
在0-10、10-20和0-30 cm土层中增氮不增温处理的物种丰富度指数、多样性指数和均匀度指数均高于增温增氮和不增氮不增温处理(图2)。在0-30 cm土层, 增氮不增温处理的物种丰富度指数和多样性指数显著高于不增氮不增温和增温增氮处理(P< 0.05)。均匀度指数也呈相同变化趋势与无显著差异(P> 0.05)。
增氮不增温处理对土壤真菌数量的影响存在争议。Bardgett等[23]认为, 在草地生态系统中, 施氮对微生物群落的影响与高氮条件下真菌含量的减少有关。Nemergut和Tounsend[24]的研究结果也显示高山冻原区草地为期18年的施氮试验使真菌的比例减少。而在美国科罗拉多长期草地施氮试验研究站的研究发现, 施氮增加了细菌的数量, 而对真菌数量没有影响[25]。陈美玲[15]对贝加尔草甸草原土壤微生物群落的研究表明增氮显著增加了土壤中真菌和细菌的比值。这可能与增氮持续的时间、增氮量、生态系统的植物群落和土壤环境不同有关系。本研究中模拟氮沉降试验(每年施氮量100 kg· hm-2)使可培养真菌的总菌落显著增加, 增氮不增温增加了可培养真菌的菌落数, 表明增氮不增温促进了真菌的生长或孢子的形成。同一试验区的研究表明氮素是试验区的主要限制因子, 增氮不增温可以显著提高植物群落地下净初级生产力[26]。但是试验区土壤可培养真菌与植物地下部分之间是对氮的可利用性存在竞争而引起的菌落数增加还是群落地下净初级生产力提高导致可分解有机物增加, 进而真菌数量增加, 或者是二类作用共同存在?具体机理有待进一步研究。同时, 由于试验地植被稀疏, 建群种单一, 所以增氮不增温处理中可培养真菌群落组成的变化和优势种发生的替代主要是由试验地增氮引起。目前, 氮沉降对土壤真菌群落多样性的影响也没有一致的结论。Newel等[26]的研究显示, 氮沉降增加了真菌的多样性和丰富度。Robinson等[27]研究表明, 模拟氮沉降5年, 腐生真菌的多样性呈降低的趋势, 然而在两年的北极半荒漠生态系统的氮沉降试验却对土壤腐生真菌的多样性没有影响。真菌群落的物种丰富度与生态系统中植物群落的多样性有关, 本试验区模拟增氮试验降低了植物群落Shannon-Wiener指数、物种丰富度和Margalef丰富度指数[28]。然而受增氮的影响, 增氮后可培养真菌的物种丰富度指数、均匀度指数和多样性指数都有不同程度的增加。这可能是由于土壤真菌群落与地上植物之间存在既相互促进又竞争的关系[29], 加之土壤环境的异质性, 所以很难确定生境尺度中真菌具体受增氮还是其它环境因子的影响[30]。隋心等[31]研究结果显示, 氮沉降增加湿地土壤细菌多样性有阈值限制性, 而增氮对荒漠草原土壤可培养真菌多样性影响是否具有阈值限制性还有待进一步研究。本研究中增氮不增温处理对不同属可培养真菌检出率的影响不同, 总体来说增氮不增温改变了荒漠草原土壤可培养真菌的群落结构, 并且使优势菌属发生了变化。具体机制有待下一步深入研究。
目前, 对于室外增温试验引起土壤微生物变化有两种观点, 其一是增温对微生物的影响几乎不存在或者很微弱[32, 33, 34, 35], 其二是增温对土壤微生物产生了显著的影响[36, 37]。这可能与增温持续的时间、增温幅度、生态系统不同以及试验地中原有微生物种类不同有关。Gutknecht等[38]研究发现增温和增氮交互作用比单独增温对加利福尼亚州草地土壤真菌/细菌的比值的影响更强烈。在条件适宜的情况下, 草地土壤微生物的数量和多样性与土壤温度呈正相关关系[39]。在本研究区的其它研究表明, 不增氮增温处理显著提高了土壤温度[14], 降低了可培养真菌菌落数量和多样性[17]。本研究中, 远红外线加热模拟增温和增氮的交互作用可以使可培养真菌的菌落数显著升高, 但是与增氮不增温处理相比差异并不显著; 同时增温增氮处理的交互作用使群落组成和优势属发生了改变。这表明本研究增氮的基础上增温在可培养真菌的菌落数量方面没有显著的促进作用。张宇[14]在本研究区对土壤特征的研究表明, 增温和增氮的交互作用改变了样地土壤的水热状况。土壤水热状况的改变直接或间接导致了土壤中的植物及动物的生长环境及它们的代谢产物[40], 所以影响了土壤中可培养真菌的组成及数量, 使群落组成和优势种发生了改变。孙良杰等[41]研究认为温度上升可能对土壤微生群落多样性产生不同的影响, 本研究增温增氮交互作用对物种丰富度指数、均匀度指数和多样性指数没有明显的影响, 物种丰富度、均匀度和多样性没有显著变化。
本研究采用传统平板培养法和微生物18S rRNA分子鉴定技术对连续6 年的室外远红外线模拟增温、人工施肥模拟增氮对短花针茅荒漠草原土壤可培养真菌的群落组成及其多样性进行了分析研究, 结果表明:1)从内蒙古荒漠草原土壤中共分离到17属32种的可培养真菌(包括增氮不增温、增温增氮处理), 其中属于青霉属的种类最多, 有11种。2) 增氮不增温、增温增氮都显著提高了荒漠草原可培养真菌的菌落数量。3) 增氮不增温显著提高了荒漠草原土壤可培养真菌的物种丰富度、均匀度和物种多样性, 使荒漠草原可培养真菌的群落组成和优势属发生改变。4)增温增氮使荒漠草原可培养真菌的群落组成和优势属发生了改变, 但对土壤可培养真菌的物种丰富度、均匀度和物种多样性没有显著影响。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|