第一作者:张桂芳(1988-),女,山西大同人,在读硕士生,主要从事观赏植物研究。E-mail:544406790@qq.com
以白鹤芋( Spathiphyllum floribundum) 'Mojo’品种的组培苗根尖为试验材料,采用常规压片法,比较不同取材时间、预处理方法对染色体制片的影响,并对其进行核型分析。结果表明,于08:45-09:15取材,用0.002 mol·L-1 8-羟基喹啉或0.07 mmol·L-1放线菌酮预处理4 h所得的染色体制片效果最佳。白鹤芋的染色体数目为2n=2x=30,为二倍体,'Mojo’品种有B染色体,核型公式为2n=2x=30=20m+6m(SAT)+2sm+2sm(SAT)(B染色体),其中3号和8号为近中部着丝粒染色体(sm),其余的染色体都是中部着丝粒染色体(m)。3号、4号、6号和9号的染色体具随体。最长染色体与最短染色体比为1.73;核型属2A型,核型不对称系数为56.37%。
To establish the optimal approach for analyzing the root tips of Spathiphyllum floribundum'Mojo’, we compared different sampling times and pretreatments during chromosome sectioning. The results showed that the optimal sampling time was 08:45-09:15 and the optimal pretreatment was 0.002 mol·L-1 or 0.07 mmol·L-1 of 8-hydroxyquinolin or cycloheximide, respectively for 4 h. S. floribundum is a diploid plant and its chromosome number is 2n=2x=30. “Mojo” contains a B-chromosome. The karyotype analysis revealed that S. floribundum is 2n=2x=30=20m+6m (SAT)+2sm+2sm(SAT) (B-chromosome). Furthermore, chromosome 3 and 8 are metacentric, whereas the others are facrocentric. Satellites were observed in the four pairs of chromosomes (3, 4, 6, and 9). The chromosomal length ratio was 1.73, mongolicus was 2A, and the karyotype asymmetry coefficient was 56.37%.
白鹤芋(Spathiphyllum floribundum)是天南星科白鹤芋属多年生常绿草本植物, 是一种理想的室内观赏花卉[1, 2]。1874 年从原产地哥伦比亚等美洲热带地区被引种至欧洲, 20 世纪初成为盆栽花卉, 我国于20世纪80年代末开始引种栽培[2]。盆栽花卉有着广阔的市场前景, 据统计[3], 2010年, 荷兰盆栽白鹤芋的年销售额已达1 990万美元, 位列荷兰盆花产量的第九位。白鹤芋具有净化空气, 过滤空气中的苯、三氯乙烯和甲醛的功能[4, 5], 具有较高的经济价值和观赏价值, 目前我国各地均有栽培[5]。
植物染色体的数目、形态特征是最稳定的细胞学特征之一[6, 7]。对染色体数目进行计数可以用来确定植物是否为多倍体以及多倍体加倍的倍性[8]。此外, 染色体核型参数、核型类型可作为物种的系统演化及其亲缘关系和分类鉴定的重要依据[6]。然而, 目前针对白鹤芋属植物染色体制片优化及核型分析的研究报道较少, 2013年刘金梅等[9]对白鹤芋属染色体的数目进行了报道, 并未对其进行更深层次的研究。本研究优化白鹤芋细胞染色体的制片条件, 并进行核型分析, 旨在为白鹤芋细胞遗传学和育种研究提供依据。
选取白鹤芋'Mojo’品种生长健壮的组培苗接入到生根培养基中, 长出新根后, 剪取新根进行试验。
1.2.1 取材时间 取组培苗新长出的根尖1.5~2 cm, 于08:00-10:00, 每隔15 min取材一次, 用0.07 mmol· L-1放线菌酮20 ℃预处理4 h, 蒸馏水漂洗3~4次, 放入卡诺氏固定液(冰醋酸∶ 无水乙醇=1∶ 3)中4 ℃下固定24 h后, 用蒸馏水清洗3~4次, 分别用蒸馏水和KCl前低渗各30 min, 然后用1 mol· L-1 HCl 60 ℃解离10 min之后, 用蒸馏水清洗干净, 再用蒸馏水后低渗10 min, 取根尖小白点, 用镊子碾碎, 卡宝品红染色10~30 min后, 制片。40倍镜下, 观察约1 000个细胞, 计算其中期分裂指数和染色体分散指数。
相关公式为:
中期分裂指数=中期分裂相细胞/观察的细胞× 100%;
染色体分散指数=适合做核型分析的中期细胞/中期分裂相细胞× 100%。
1.2.2 预处理方法 采用不同的预处理方法对根尖进行处理, 分别用0.002 mol· L-1 8-羟基喹啉、饱和对二氯苯溶液、0.1%秋水仙素、0.07 mmol· L-1放线菌酮、0.1%秋水仙素与0.002 mol· L-1 8-羟基喹啉(1∶ 1)混合液及0.07 mmol· L-1放线菌酮与0.002 mol· L-1 8-羟基喹啉(1∶ 1)混合液20 ℃下预处理2、4和6 h, 以及冰水混合物4 ℃下预处理24 h。
1.2.3 染色体核型分析 选取30个染色体分散和缩短较好的细胞, 对其染色体进行计数, 将85%以上细胞具有的染色体数目作为白鹤芋的染色体数目。以85%以上的细胞具有相同的染色体数作为该种的染色体数, 选取5个分散较好的中期分裂相细胞, 使用Photoshop 软件对染色体进行测量和配对, 取平均值计算核型数据核型分析。利用Excel 及画图软件绘制核型模式图。依照李懋学等[10, 11]提出的标准对其进行核型分析; 着丝点位置则根据Levan等[12]提出的命名法则来确定; 染色体核型分类按照Stebbins[7]提出的标准划分, 染色体相对长度指数(I.R.L)参考Kuo[13]提出的方法计算; 按Arano[14]的方法计算核型不对称系数(As.K)。
相关公式为:
臂比=长臂长度/短臂长度;
着丝粒指数=短臂长度/染色体组总长度× 100%;
染色体相对长度=染色体长度/染色体组总长度× 100%;
染色体相对长度指数=染色体长度/全组染色体平均长度;
核型不对称系数=长臂总长度/全组染色体总长度× 100%[14]。
从08:00开始白鹤芋根尖的染色体分裂指数逐渐增大(表1), 到09:15时达到最大, 为5.48%, 随后, 其分裂指数又逐渐减小。染色体分散指数在08:45和09:15时达到最大, 为50%。08:45和09:00的染色体中期分裂指数也较大, 可以作为染色体制片的取材时间, 所以白鹤芋染色体制片的最佳取材时间段为08:45-09:15, 最佳的取材时间为09:15。
| 表1 不同取样时间对染色体制片的影响 Table 1 Effect of different sampling time on chromosome preparation |
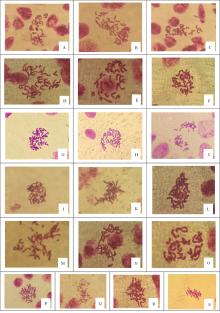
对比分析各预处理方法对染色体制片的影响(图1), 结果表明, 0.1%秋水仙素预处理条件下, 2 h的染色体缩短程度较差, 呈丝状。4和6 h的染色体均缩短的非常好, 呈短棒状, 但6 h的染色体分散效果不是很好, 而预处理4 h的染色体分散效果较好, 所以以0.1%秋水仙素预处理4 h适合白鹤芋染色体制片。0.002 mol· L-1 8-羟基喹啉预处理条件下, 4 h的效果最好, 染色体缩短适中, 清晰, 分散效果好, 且染色背景清晰。2 h的染色体缩短程度差, 呈丝状, 6 h的染色体缩短程度较高, 但分散效果不好, 两个时间均不利于染色体计数与核型分析。0.07 mmol· L-1放线菌酮预处理条件下, 2和4 h的染色体缩短均较好, 染色体清晰, 但预处理2 h的染色体分散程度要比4 h的差; 6 h的染色体缩短程度较高, 呈极短棒状, 对核型分析不利。饱和对二氯苯预处理条件下, 2和4 h的处理效果均较差; 6 h的处理效果较好, 染色体缩短较好, 染色体清晰, 分散效果好, 但其中期分裂指数较低, 可以作为白鹤芋的染色体制片。0.07 mmol· L-1放线菌酮与0.002 mol· L-1 8-羟基喹啉(1∶ 1)混合液预处理条件下, 3种预处理时间下的染色体分散效果都较好, 预处理4 h的染色体呈短棒状, 染色体清晰, 制片效果最好; 预处理2和6 h的染色体分别呈长棒状和极短棒状, 都不适合做染色体的核型分析。0.07 mmol· L-1放线菌酮与0.002 mol· L-1 8-羟基喹啉(1∶ 1)混合液预处理条件下, 4与6 h效果差别不大, 染色体缩短程度较好, 染色体较清晰, 染色背景清晰, 但染色体的分散程度较差, 2 h要比4和6 h的效果差, 因此该处理液不适合白鹤芋染色体制片。冰水混合物4 ℃预处理24 h条件下, 染色体缩短正好, 染色体清晰, 但染色体的分散程度较差, 若能提高染色体的分散度, 则是白鹤芋染色体制片较好的选择。
注:A-C, 0.1%秋水仙素预处理2、4、6 h; D-F, 0.002 mol· L-1 8-羟基喹啉预处理2、4、6 h; G-I, 0.07 mmol· L-1放线菌酮预处理2、4、6 h; J-L, 饱和对二氯苯预处理2、4、6 h; M-O, 0.1%秋水仙素与0.002 mol· L-1 8-羟基喹啉混合液预处理2、4、6 h; P-R, 0.07 mmol· L-1放线菌酮与0.002 mol· L-1 8-羟基喹啉混合液处理预2、4、6 h; S, 冰水混合物4 ℃下预处理24 h。
Note: A-C, 0.1% Colchicine pretreatment times, 2, 4, and 6 h; D-F, 0.002 mol· L-1 8-hydroxyquinoline, pretreatment times, 2, 4, and 6 h; G-I, 0.07 mmol· L-1 actidione, pretreatment times 2, 4, and 6 h; J-L, Saturated 1, 4 dichlorophenyl solution, pretreatment times, 2, 4, and 6 h; M-O, mixture of 0.1% colchicine and 0.002 mol· L-1 8-hydroxyquinoline, pretreatment times, 2, 4, and 6 h; P-R, mixture of 0.07 mmol· L-1 actidione and 0.002 mol· L-1 8-hydroxyquinoline, pretreatment times, 2, 4, and 6 h; S mixture of ice and water (4 ℃), pretreatment time, 24 h.
综合比较各处理组的中期分裂指数、染色体分散指数以及染色体制片效果, 0.1%秋水仙素、0.002 mol· L-1 8-羟基喹啉、0.07 mmol· L-1放线菌酮及0.07 mmol· L-1放线菌酮与0.002 mol· L-1 8-羟基喹啉(1∶ 1)混合液, 预处理4 h均适合白鹤芋的染色体制片。饱和对二氯苯预处理6 h也可以作为白鹤芋的染色体制片方法。而最适合白鹤芋染色体制片的是0.002 mol· L-1 8-羟基喹啉和0.07 mmol· L-1放线菌酮, 预处理4 h。
按照植物核型分析标准, 对白鹤芋的染色体进行核型分析。选取30个染色体分散和缩短较好的细胞进行染色体计数, 测量每一组染色体的长臂和短臂。根据公式计算其染色体相对长度、臂比、着丝粒指数以及染色体相对长度指数, 利用Photoshop 软件对染色体按照总长度由长至短的顺序进行排列和编号(表2, 图2-4)。
| 表2 白鹤芋染色体核型分析 Table 2 Karyotype parameters of chromosome in Spathiphyllum floribundum |
结果发现, 白鹤芋'Mojo’的染色体数目为2n=2x=30, 有1条B染色体。其中3号和8号为近中部着丝粒染色体(sm), 占染色体总数的13.33%, 其余的染色都是中部着丝粒染色体(m), 占染色体总数的86.67%。3号、4号、6号和9号的染色体具随体, 且3号和4号的随体在长臂上, 6号和9号的随体在短臂上。核型公式为2n=2x=30=20m+6m(SAT)+2sm+2sm(SAT)(B染色体), 最长染色体与最短染色体比为1.73, 染色体相对长度在3.57%~10.12%, 染色体相对长度指数在0.53~1.54。白鹤芋的核型为2A型, 核型不对称系数为56.37%。
取材部位、取材时间和预处理方法等都对染色体制片有很大的影响, 采用嫩叶或茎的细胞制片, 细胞分裂也极少, 再加上去除其细胞壁的时间不好控制, 而且其细胞壁不易去除, 所以制片时能观察到的细胞分裂相较少, 与之相比, 植物的根尖细胞分裂能力较强, 制片较为容易, 是研究有丝分裂过程的理想材料[15]。理论上, 任何时间取样制片, 都可以从新根中获得中期分裂相细胞。植物细胞染色体的分裂高峰期一般在08:00-10:00[16] , 相关研究表明, 火龙果(Hylocereus undatus)气生根染色体制片的最佳取材时间为10:30[17]; 对树上干杏(Armeniaca)进行核型分析研究时发现, 其取材的最佳时间为08:30[8]。本研究初步发现, 白鹤芋染色体制片的最佳取样时间为08:45-09:15, 这与百里香(Thymus mongolicus)[18]核型分析研究中得出的结论一样。
预处理在染色体制片过程中起到关键性作用, 对材料进行预处理主要是阻断纺锤体的形成, 使细胞分裂终止在中期阶段, 从而提高中期分裂相的出现频率[18], 优化染色体的制片效果。而不同的植物其预处理方法一般也不同, 菠萝蜜(Artocarpus heterophyllus)染色体制片的最佳预处理方法为以0.002 mol· L-1 8-羟基喹啉与0.2%秋水仙素(1∶ 1)混合液作为预处理剂, 预处理3 h[19]; 春石斛(nobile-type Dendrobium)的染色体制片中使用0.002 mol· L-1 8-羟基喹啉与饱和对二氯苯的混合液预处理4 h的效果最佳[20]; 。药材五鹤续断(Dipsacus asper)染色体制片的最佳预方法是用0.1%秋水仙素预处理2.5 h[21]。本研究发现, 白鹤芋染色体最佳的预处理方法是用0.002 mol· L-1 8-羟基喹啉或0.07 mmol· L-1放线菌酮预处理4 h。用0.002 mol· L-1 8-羟基喹啉作为预处理液, 处理4 h, 获得的染色体主、次缢痕清晰, 染色体缩短适中, 分散效果好。用0.07 mmol· L-1放线菌酮预处理4 h获得的染色体缩短较好, 染色体清晰, 且分散效果好。
本研究得出白鹤芋的染色体数目为30, 为二倍体, 且'Mojo’品种具有B染色体, 这与刘金梅等[6]的报道一致。一般染色体的核型进化趋势是由对称向不对称方向演化, 系统演化上处于比较原始或古老的植物, 大多具有较对称的核型, 而衍生的、特化的以及比较进化的植物类群, 核型大多不对称[22]。白鹤芋的不对称系数为56.37%, 具有较高的对称性。B染色体是独立存在于物种染色体之外的一种特殊染色体, 又被称为超染色体、附加染色体或额外染色体[23]。本研究发现白鹤芋'Mojo’品种具有B染色体, 而刘金梅等[6]在对白鹤芋的19个种或品种染色体的研究中发现, 除了'Mojo’品种外, 还有其它的2个种5个品种也同样具有B染色体。B染色体的存在会影响A染色体交叉的分布及频率, 而且对A染色体上特定基因的表达具有积极意义, 从而影响个体的适应性[24]。所以, 白鹤芋中B染色体的存在可能有增强其适应性的作用。随体特征是重要的细胞学标记, 有可能作为杂种早期鉴定的细胞学特征[25], 白鹤芋染色体上的随体可作为其杂种鉴定的标记。染色体的随体一般在短臂上, 但本研究发现'Mojo’品种在3号和4号染色体长臂上也存在随体, 其作用有待进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|