第一作者:刘若慈(1992-),女,广东广州人,硕士,主要从事草地生态研究。E-mail:liurc811@sina.com
在内蒙古库布齐沙地研究了根瘤菌拌种比例对紫花苜蓿( Medicago sativa)生长和结瘤的影响。紫花苜蓿品种为“4010”,按根瘤菌与苜蓿种子的质量比,设0、10、20 g·kg-1 3种处理,测定株高、根瘤数随时间的变化和两茬的产量和营养含量。结果表明,根瘤菌拌种对苜蓿株高、根瘤、产量以及第1茬的茎叶比和营养含量均有显著影响( P<0.05)。经拌种处理的根瘤数比不拌种的对照组多14倍。20 g·kg-1拌种时株高和产量最高,株高比不拌种高6.8 cm;两茬干草总产量比不拌种高1.79 t·hm-2;10 g·kg-1拌种使第1茬的茎叶比减小、粗蛋白含量增加、酸性洗涤纤维和中性洗涤纤维含量减少。产量和营养没有同时达到最佳水平,在实际应用中,还应连同生产成本等因素综合考虑,选择最佳根瘤菌用量。
The effect of Rhizobium dosage on the growth and nodule characteristics of alfalfa ( Medicago sativa) was investigated in Kubuqi Sandland, Inner Mongolia. The seeds of alfalfa cultivar ‘4010’ were mixed with Rhizobium Dormal at ratios of 0, 10, and 20 g·kg-1 and then sown. Each treatment had three replicates. Indices of growth, nodules, yield, and nutrient contents were measured periodically. The results showed that Rhizobium had a significant influence on plant height, nodule formation, yield, and nutrition content at the first harvest ( P<0.05). Rhizobium inoculation resulted in a 14-fold increase in nodule number compared with the 0 g·kg-1 treatment. The 20 g·kg-1 treatment resulted in the highest values for plant height and hay yield, resulting in an increase in plant height of 6.8 cm and an increase in hay yield of 1.79 t·hm-2. The 10 g·kg-1 treatment significantly decreased the stem/leaf ratio and resulted in a higher CP content and lower Acid Detergent Fiber (ADF) and Neutral washing fiber (NDF) contents at the first harvest. The maximum yield and best nutrition quality were not obtained simultaneously. In practical production, factors including cost also need to be taken into account when determining the optimal Rhizobium dosage.
紫花苜蓿(Medicago sativa)是优质的豆科牧草, 具有产量高、品质好、适应面广等特点。自2012年1月中央“ 1号文件” 提出“ 振兴奶业 苜蓿发展行动” 以及后续提出“ 草牧业” 、“ 粮改饲” 以来, 我国苜蓿规模化种植面积发展迅速, 苜蓿生产规模和生产水平得到很大提升。纵观我国苜蓿生产区域, 主要集中在西北, 华北和东北干旱、半干旱气候区, 这里不仅具有适宜苜蓿生长的生态环境, 而且土地面积广阔。但当地水资源短缺, 而且种植苜蓿的土地大多为保水保肥性差的砂性土地[1]。砂性土壤氮、磷及有机质等养分含量低[2], 不仅不能满足苜蓿生长的需要, 而且水肥保持性差, 还会增加苜蓿生产成本。
近年来有众多研究为提高紫花苜蓿的生长品质提供了理论和方法, 如地下滴灌和施用硅肥[3]、铁锌配施[4]和施用腐殖酸钠[5]等处理均有助于提高苜蓿的生物量。接种根瘤菌也是促进苜蓿生长的好方法。
根瘤菌是豆科植物结瘤固氮所必需的共生细菌[6]。根瘤菌通过根毛尖端进入根内生长繁殖, 促使根细胞分裂形成根瘤, 根瘤菌在根瘤内利用光合产物作为养料的同时, 还能固定空气中的游离氮形成氮化物, 从而起到固氮作用。众多研究表明, 接种根瘤菌可增加苜蓿的固氮量[7], 提高生长速度, 减少茎叶比[8], 增加草产量[9, 10, 11, 12], 提高粗蛋白含量[9]并减少中性洗涤纤维[13]。根瘤菌也能够增强苜蓿的抗逆性, 如抗干旱胁迫[14, 15]、耐盐性[16]以及抗病性[17]等。增加根瘤菌接种量, 亦可进一步促进苜蓿结瘤固氮, 增加产量[9]。
在生产实践中, 常在播种前按一定比例对紫花苜蓿种子进行根瘤菌拌种。本研究在内蒙古库布齐沙地进行, 选用适于我国北方生长的侧根型紫花苜蓿品种‘ 4010’ 和商用“ 多萌” 根瘤菌, 研究根瘤菌不同拌种比例对沙地紫花苜蓿生长、结瘤、产量和品质的影响, 以期为沙地苜蓿种植提供一些试验依据。
试验在亿利资源集团沙漠研究院精品种植园试验基地进行, 位于内蒙古自治区鄂尔多斯市杭锦旗独贵塔拉镇西部(108° 42' E, 40° 36' N), 在库布齐沙地北部, 距黄河7.8 km, 海拔为1 053 m。气候属于温带大陆性气候, 年均温6.4~7.3 ℃, 年均降水量186.0 mm。因临近黄河, 试验地地下水埋深3 m左右。试验进行时间为2016年4-9月, 期间的最高气温36.0 ℃, 最低气温-1.0 ℃。7、8月份为雨季, 期间降水量144.2 mm。试验地光照及通风条件良好。
试验地近4年内未种植其他作物, 2012年前曾种植甘草(Glycyrrhiza uralensis)。试验地土壤养分状况:有机质7.40 g· kg-1, 总氮0.49 g· kg-1, 总磷0.36 g· kg-1, 总钾17.50 g· kg-1。
根瘤菌选用商用“ 多萌” (Dormal)根瘤菌, 拌种简便, 且适应我国沙地环境条件。紫花苜蓿品种为侧根型苜蓿‘ 4010’ , 秋眠级为3.6, 耐寒性强, 适宜在我国北方种植。根瘤菌及苜蓿品种均由北京克劳沃草业技术开发中心提供。
播种前, 用“ 多萌” 根瘤菌和‘ 4010’ 紫花苜蓿种子按重量比例拌种, 本研究设0、10、20 g· kg-1共3种拌种量处理, 播种量均为4.5 g· m-2, 各个小区的面积均为7.5 m2, 每个小区播种34 g, 相应比例的根瘤菌用量为每个小区0、0.34、0.68 g。每种处理3次重复, 共计9个小区。9个小区从东至西排列, 将不同比例的拌种按完全随机设计播种于各个试验区中。每个小区开沟5条, 每隔20 cm开沟, 8 cm深, 将拌种均匀的撒入沟中, 将其覆盖并踩实, 保证各小区灌溉等管理一致。4月18日播种, 分别在7月17日和8月17日每茬初花期时收割, 共收获两茬。试验期间未进行施肥处理。
1.4.1 株高 从每个小区随机选取10株植株, 用直尺测定每株茎的最底部至最顶端叶尖或花序最顶端的高度。从5月11日起每隔约15 d测定一次。
1.4.2 产量和营养 干草产量:在7月17日和8月17日苜蓿初花期(20%开花), 对每个小区选取3处50 cm× 50 cm的样方进行收割, 将样品于105 ℃杀青1 h, 再经70 ℃烘干48 h, 冷却后称量其干重。
茎叶比:将所选植株一级分枝茎叶分离, 烘干冷却后分别称量茎和叶的干重, 花序的干重归为叶片干重。茎叶比为茎干重与叶干重的比值。
将苜蓿样品烘干后粉碎, 并通过0.5 mm孔筛后, 测定其营养指标。
粗蛋白(CP)用FOSS KJELTEC 2300全自动凯氏定氮仪测定。酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)用ANKOM 2000i全自动纤维分析仪测定。
根据上述营养指标, 计算可消化的总养分以及相对饲喂价值, 公式计算如下。
可消化的总养分(TDN)=82.38-(0.751 5× ADF);
相对饲喂价值(RFV)=(120/NDF)× [88.9-(0.779× ADF)]/1.29× 100%.
1.4.3 根瘤指标 从5月11日起, 每隔约15 d, 在每个小区取3处边长20 cm、深30 cm样方的根系, 统计每个样方的根瘤总数和有效根瘤数(根瘤切开呈粉色或浅粉色)。
采用IBM SPSS Statistics 22对同一测量时间不同拌种比例处理进行单因素方差分析(ANOVA), 用Microsoft Excel 2010进行所有试验数据的整理和图表绘制。
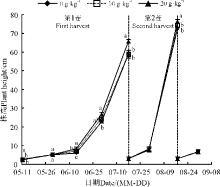
2.1.1 根瘤菌不同拌种比例对苜蓿株高的影响 紫花苜蓿株高在生长初期生长较缓慢, 之后生长速度加快, 株高大幅提升。从6月14日开始, 根瘤菌拌种的苜蓿株高大于不拌种, 20 g· kg-1拌种苜蓿的株高最大, 而不拌种的株高最小。随时间推移, 20 g· kg-1拌种的株高与其他两种处理的差距逐渐增大。在7月17日第1茬初花期时, 20 g· kg-1拌种苜蓿的株高为65.8 cm, 显著高于不拌种的株高(P< 0.05)。第2茬与第1茬的生长趋势相似, 生长速度高于第1茬, 株高也略高于第1茬。0、10和20 g· kg-1拌种苜蓿的株高分别为72.4, 74.2和76.4 cm。第3茬仅有一次测量, 此时生长较为缓慢, 根瘤菌拌种的作用尚不明显(图1)。
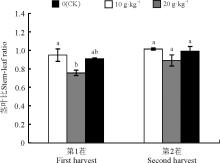
2.1.2 根瘤菌不同拌种比例对苜蓿茎叶比的影响 对于茎叶比, 第1茬时拌种的茎叶比小于不拌种。10 g· kg-1拌种的茎叶比显著低于不拌种(P< 0.05), 比不拌种低20.3%。第2茬时, 3种拌种处理下茎叶比的差异不显著, 但仍然以不拌种最高(图2)。
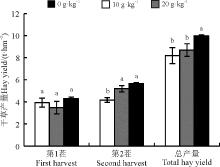
2.2.1 根瘤菌不同拌种比例对苜蓿产量的影响总体上两茬干草产量均以20 g· kg-1拌种处理的最高。第1茬中, 各个拌种处理间干草产量差异不显著(P> 0.05); 第2茬中, 20 g· kg-1拌种的干草产量比10 g· kg-1拌种高9.0%(P> 0.05), 比不拌种高35.9%(P< 0.05)。20 g· kg-1拌种时两茬的干草总产量显著高于10 g· kg-1拌种和不拌种(P< 0.05), 比不拌种高21.8%(图3)。
2.2.2 根瘤菌不同拌种比例对苜蓿品质的影响 在第1茬时, 根瘤菌拌种比例为10 g· kg-1时, 苜蓿的粗
蛋白含量、相对饲喂价值和可消化的总养分显著高于20 g· kg-1拌种和不拌种(P< 0.05), 酸性洗涤纤维和中性洗涤纤维显著小于20 g· kg-1拌种和不拌种(P< 0.05)。第2茬时, 10 g· kg-1拌种处理的粗蛋白高于不拌种, 低于20 g· kg-1拌种, 酸性洗涤纤维和中性洗涤纤维小于20 g· kg-1拌种和不拌种, 相对饲喂价值和可消化的总养分刚好相反, 但所有指标拌种与不拌种间、不同拌种比例间均无显著差异(P> 0.05)(表1)。
| 表1 根瘤菌不同拌种比例对苜蓿两茬品质的影响 Table 1 Influence of different Rhizobium dosages on the nutrient content of alfalfa |
注:同列同茬不同小写字母表示不同根瘤菌拌种量之间差异显著(P< 0.05)。
Note: Different lowercase letters within the same column indicate significant differences among different Rhizobium dosages in the same harvest at the 0.05 level. CP, crude protein; ADF, acid detergent fiber; NDF, neutral detergent fiber; RFV, relative feeding value; TDN, total digestible nutrient.
从5月11日到8月30日分阶段观测了苜蓿的有效根瘤数。经过拌种的苜蓿有效根瘤数大幅增加, 20和10 g· kg-1拌种的有效根瘤数增幅大于不拌种。不拌种的有效根瘤数增加较少。整个测量阶段, 20和10 g· kg-1拌种的累积有效根瘤数始终显著大于不拌种(P< 0.05), 从7月30日起, 20 g· kg-1拌种的累积有效根瘤数略大于10 g· kg-1拌种(图4)。
本研究中, 在紫花苜蓿出苗早期, 经过根瘤菌拌种的苜蓿株高与不拌种间差异不大, 之后紫花苜蓿生长速度增大, 拌种与不拌种的苜蓿株高也逐渐拉开差距。在初花期收割时, 拌种与不拌种的株高差距最大, 说明根瘤菌对苜蓿株高的作用随苜蓿生长时间的延长逐渐增强, 这一结果在以前的研究中也有体现[9], 比如在河南新郑用“ 多萌” 根瘤菌拌种较拌种的紫花苜蓿株高增加了21.3%, 本研究中在库布齐沙地种植的苜蓿, 20 g· kg-1拌种的株高最高, 比不拌种高36.7%, 同时, 株高随拌种量的增加而增加, 说明增大拌种量可促进株高的增加[9]。
国内外已有众多文献证明根瘤菌对紫花苜蓿有增产作用[9, 10, 11]。研究表明, 在砂质土壤、海滨盐渍土壤、土壤肥力低且有板结问题的沙质土中, 根瘤菌拌种均能起到显著的增产作用, 产量比不拌种高60%[7]。本研究在库布齐沙地也得出相似结论, 20 g· kg-1根瘤菌拌种干草产量比不拌种高21.8%。
至于根瘤菌对紫花苜蓿品质的影响, 本研究中拌种比例为10 g· kg-1时第1茬紫花苜蓿粗蛋白含量达到20.55%, 比不拌种仅高出11.08%。而第2茬中3个拌种水平的紫花苜蓿品质差异不显著。由于紫花苜蓿的粗蛋白含量与茎叶比存在显著相关性[14], 茎中蛋白质含量小于叶, 而中性洗涤纤维和酸性洗涤纤维含量大于叶, 营养含量也受茎叶比影响[18, 19]。因此, 从研究结果看根瘤菌对紫花苜蓿品质的影响并不显著, 其原因需要进一步研究。
另外, 沙地上紫花苜蓿根瘤菌拌种在苗期就可显著提高根瘤数, 与陈力玉等[20]的研究结果相似。李夺和王云平[7]的研究表明, 在北京地区“ 多萌” 根瘤菌使
根瘤数增加64%~196%, 本研究中, 经过拌种的苜蓿根瘤总数可达不拌种的14倍。樊川等[9]研究发现, 根瘤数随根瘤菌用量的增加而增加, 而本研究中, 拌种比例20和10 g· kg-1的根瘤总数总体上差异不显著, 但始终显著大于(P< 0.05)不拌种的根瘤数。商用“ 多萌” 根瘤菌通常向生产者推荐的拌种比例为8~12
1)在库布齐沙地土壤条件下, 根瘤菌拌种量20 g· kg-1时的苜蓿株高和产量最大。在每茬初花期时, 20 g· kg-1拌种的株高比不拌种平均高出6.9 cm, 比10 g· kg-1拌种平均高出6.7 cm。20 g· kg-1拌种的干草两茬总产量比不拌种高出1.79 t· hm-2, 比10 g· kg-1拌种平均高出1.29 t· hm-2。
2)沙地苜蓿根瘤菌拌种可显著提高苜蓿的有效根瘤数(P< 0.05), 10和20 g· kg-1拌种的有效根瘤数显著大于不拌种(P< 0.05), 试验中10和20 g· kg-1拌种的累积有效根瘤数达不拌种的3倍。
3)根瘤菌10 g· kg-1拌种使苜蓿第1茬营养水平最佳, 粗蛋白含量比不拌种高11.08%, 中性洗涤纤维和酸性洗涤纤维含量分别比不拌种低10.61%和12.55%。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|