第一作者:许楠(1982-),男,黑龙江哈尔滨人,助理研究员,博士,主要从事植物生理生态学研究。E-mail:xunan0451@126.com
以桑树( Morus alba)为试验材料,在室内以溶液培养的方法研究了增施NO-3-N(7.5 mmol·L-1增加到17.5 mmol·L-1)对Na2CO3胁迫(50 mmol·L-1)下桑树幼苗叶片PSⅡ功能的影响。结果表明,50 mmol·L-1的Na2CO3胁迫下桑树植株表现出明显的盐害症状,叶片的PSⅡ反应中心光化学活性明显降低,PSⅡ电子供体侧和受体侧均受到不同程度的影响。增施N O-3-N显著提高了Na2CO3胁迫下桑树幼苗叶片的光合电子供应和传递能力,表现为PSⅡ电子供体侧放氧复合体OEC的功能增强,PSⅡ电子受体侧受体库接受电子能力增加。另外,增施N O-3-N还可以相对提高桑树幼苗叶片类囊体膜结构的稳定性,促进Na2CO3胁迫下桑树幼苗叶片光能向光化学反应方向的分配,降低以无效热能形式耗散的比例。可见,增施N O-3-N可显著增强Na2CO3胁迫下桑树幼苗叶片PSⅡ的功能,这为其光合作用的正常进行提供了保证。
In this study, we analysed the effects of increased nitrate (N O-3-N) (from 7.5 mmol·L-1 to 17.5 mmol·L-1) on the growth and photosynthetic characteristics of mulberry seedlings, which were subjected to alkaline salt (50 mmol·L-1 Na2CO3) stress using hydroponic methods. The results showed that plants displayed obvious symptoms of injury when subjected to 50 mmol·L-1 Na2CO3 stress. Furthermore, compared with the control, the photochemical reaction centre activity of PSⅡ in stressed seedlings was significantly decreased, and electron transport was affected to different degrees on both the donor side and receptor side of PS Ⅱ. Under Na2CO3 stress, increasing N O-3-N promoted photosynthetic electron supply and transmission capacity, enhanced the function of the oxygen complex in the electron donor of PS Ⅱ, and increased the acceptor electron capacity of the receptor library. In addition, increasing N O-3-N also improved the stability of leaf thylakoid membrane structure, promoted the distribution of more light energy to the photochemical reaction centre, and decreased the proportion of energy in the form waste heat dissipation. In conclusion, increasing N O-3-N enhanced the function of PS Ⅱ under 50 mmol·L-1Na2CO3 stress, which ensured the normal operation of photosynthesis.
氮是植物体内最为重要的大量元素之一[1], 植物对氮素的吸收主要为根系对硝态氮(N
盐碱胁迫是限制植物生长的重要因子之一, 全世界约有20%的耕地面积受到不同程度盐碱化的影响[6, 7], 预计到2050年面积将会达到50%[8]。特别是以Na2CO3为主的碱性盐, 是危害我国松嫩平原盐碱地最主要的盐类, 并且Na2CO3胁迫对植物的影响也明显大于中性盐NaCl[9, 10]。合理施用氮肥不但可以促进植物的生长[11], 提高植物的光合碳代谢能力和蛋白质合成能力[12], 还对增强植物的抗逆能力方面也发挥重要作用[13, 14, 15, 16], 例如增施氮肥提高芥菜(Indian mustard)[14]、大麦(Hordeum vulgare)[15]和油菜(Brassica campestris)[16]等植物的抗逆能力方面已经得到了证实。
桑树(Morus alba)是我国栽培最早而且用途最广的栽培植物, 依据桑树的用途可分为蚕桑、食用桑、果桑、饲料桑和绿化桑等。桑树叶片的营养丰富, 蛋白质含量与苜蓿(Medicago sativa)相仿, 比禾本科牧草高80%~100%, 桑树(Morus alba)在N
试验于2012年在东北林业大学植物生理学实验室进行。试验材料为1年龄青龙桑实生苗。幼苗水培于1/2Hoagland完全营养液不透光水培箱中, 电动气泵通气, 营养液每隔3 d更换一次。水培养箱规格:直径25 cm, 高30 cm, 体积为10 L。幼苗于温度约为25 ℃的室内, 在光照强度为400 μ mol· (m2· s)-1、光周期12/12 h(光/暗)人工LED白光灯架下培养。待幼苗长至约8片叶时, 进行试验处理。
将长势相对一致的18株幼苗平均分为3组, 即每个处理6株重复。第一组:Na2CO3胁迫处理, 在1/2Hoagland营养液中加入Na2CO3使其浓度达50 mmol· L-1; 第二组:增施N
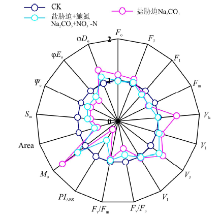
快相叶绿素荧光动力学曲线的测定:选择不同处理下桑树幼苗顶端第2片完全展开叶片, 利用Mini调制式掌上叶绿素荧光仪(FluorPen FP 100 max, 捷克)测定经过0.5 h暗适应后叶片的OJIP曲线, 5次重复。其中OJIP曲线上O、J、I和P点的相对荧光强度(Fo、FJ、FI和Fm)对应的时间分别为0、2、30和1 000 ms, L和K点相对荧光强度(FL和FK)分别表示0.15和0.3 ms对应的时刻。为分析J、I、L和K点相对可变荧光(VJ、VI、VL和VK)的变化, 分别将O-P、O-J和O-K曲线标准化, 方法参照胡举伟等[19]。按照Strasser等[20]的方法对OJIP曲线进行JIP-test分析, 得到PSⅡ 最大光化学效率(Fv/Fm)、PSⅡ 潜在光化学活性(Fv/Fo)、以吸收光能为基础的光合性能指数(PIABS)、荧光上升的初始斜率(Mo)、QA完全被还原所需要的能量(Sm)、荧光曲线与Fm所围面积(Area)、2 ms时有活性反应中心的开放程度(Ψ o)、吸收光能用于QA-以后的电子传递的能量比例(φ Eo)和非光化学猝灭的最大量子产额(φ Do)等叶绿素荧光参数。将CK的各叶绿素荧光参数定义为1, 利用其它处理与CK的比值绘制叶绿素荧光参数变化的雷达图。
运用Excel和DPS软件对测定数据进行统计分析。
50 mmol· L-1的NaCO3胁迫抑制了桑树幼苗的地上部生长, 植株高度、冠幅明显小于CK, 并且叶片面积也较CK明显降低, 特别是下部叶片的盐害症状更为明显, 甚至出现了盐斑, 叶片边缘有卷曲现象(图1)。但是, 增施硝态氮处理明显缓解了桑树幼苗的盐害症状, 与NaCO3胁迫相比, 植株的冠幅、叶面积均明显增加, 叶片面积增大。
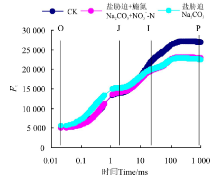
Na2CO3胁迫下桑树幼苗叶片OJIP曲线上O-J点的相对荧光强度与CK相比均明显上升, 但到I点(30 ms)时基本与CK无明显差异, 当超过I点时, CK桑树叶片上相对荧光强度上升幅度明显大于Na2CO3胁迫处理。Na2CO3胁迫+施氮处理下桑树幼苗叶片的OJIP曲线形态与Na2CO3胁迫基本相似, 其中O、I和P点均无明显差异, 但J点的相对荧光强度却较Na2CO3胁迫明显降低。
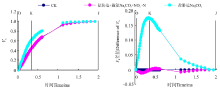
将不同处理下桑树幼苗叶片的OJIP曲线标准化后可以看出(图3), 分别将O点和P点的相对可变荧光定义为0和1后, Na2CO3胁迫下桑树幼苗叶片VJ和VI较CK均明显增加, 并且VJ的增加幅度明显大于VI。增施硝态氮处理后明显降低了Na2CO3胁迫下桑树幼苗叶片VJ和VI的增加幅度。将不同处理下桑树幼苗叶片的标准化O-P曲线与CK做差值可以看出(图3), Na2CO3胁迫下桑树幼苗叶片VJ较CK增加了约0.17, 而Na2CO3胁迫+施氮处理仅较CK增加了仅0.1左右。不同处理下VI之间变化幅度较小, Na2CO3胁迫下较CK有小幅增加, 但Na2CO3胁迫+施氮处理下VI却与CK无明显差异。
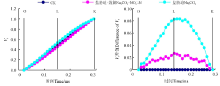
Na2CO3胁迫下桑树幼苗叶片标准化O-J曲线上VK明显增加(图4), 但是增施硝态氮处理却明显缓解了Na2CO3胁迫下桑树幼苗叶片VK的上升, 并且Na2CO3胁迫+施氮处理下桑树幼苗叶片的O-J曲线基本与CK重合。另外, Na2CO3胁迫处理和Na2CO3胁迫+施氮处理O-J曲线分别与CK做差值也可以看出(图4), Na2CO3胁迫处理下以VK变化幅度最大, 但Na2CO3胁迫+施氮处理却没有发生明显变化。
不同处理下桑树幼苗叶片标准化O-K曲线约在0.15 ms时的差异程度最大(图5), Na2CO3胁迫下桑树幼苗叶片标准化O-K曲线上Vt明显增加, 但Na2CO3胁迫+施氮处理O-K曲线与CK之间的差异程度明显小于Na2CO3胁迫处理。不同处理与CK之间做差值也可以看出(图5), Na2CO3胁迫处理桑树幼苗叶片的VL与CK相比增加了0.08左右, 但Na2CO3胁迫+施氮处理却仅增加了约0.02。
Na2CO3胁迫处理明显改变了桑树幼苗叶片的叶绿素荧光参数(图6), 但是增施硝态氮处理却明显缓解了Na2CO3胁迫下桑树幼苗叶片叶绿素荧光参数的变化幅度。其中, Na2CO3胁迫下桑树幼苗叶片的Fo和FJ较CK分别增加了12.2%和9.3%, 而Na2CO3胁迫+施氮处理却没有发生明显变化, Na2CO3胁迫和Na2CO3胁迫+施氮处理下桑树幼苗叶片的FI和Fm均较CK明显降低, 但Na2CO3胁迫和Na2CO3胁迫+施氮处理之间无明显差异。Na2CO3胁迫+施氮处理下桑树幼苗叶片的VL、VK、VJ和VI较Na2CO3胁迫也分别降低了5.8%、45.9%、12.1%和2.4%, 其中以VK和VJ的变化幅度较大。虽然不同处理之间桑树幼苗叶片的Fv/Fm降低幅度较小, 但Na2CO3胁迫下桑树幼苗叶片的Fv/Fo和PIABS却较CK分别降低了31.1%和76.8%, 而Na2CO3胁迫+施氮处理仅降低了16.2%和46.9%。另外, Na2CO3胁迫下桑树幼苗叶片的Area、Sm、Ψ o和φ Eo均明显降低, 而φ Do则明显增加, 而Na2CO3胁迫+施氮处理下桑树幼苗叶片的Area、Sm、Ψ o和φ Eo分别高于Na2CO3胁迫处理8.6%、6.6%、7.9%和11.1%, φ Do却降低了18.5%。
有研究表明, 增施N
为了进一步分析增施N
Sm反映了使QA完全被还原所需要的能量, Sm和Area均是反映PSⅡ 受体库容量的重要指标[31]。Mo为QA被还原的最大速率, 而Ψ o反映照光2 ms时有活性的反应中心的开放程度, 受PSⅡ 供体侧的电子供应能力和受体侧接收电子的能力制约[32]。本研究中, Na2CO3胁迫下桑树幼苗叶片的Sm、Area和Ψ o均较CK明显降低, 即PSⅡ 受体库容量、PSⅡ 受体接受电子能力及吸收光能用于
50 mmol· L-1的Na2CO3胁迫下桑树叶片的PSⅡ 反应中心光化学活性明显降低, 并且PSⅡ 电子供体侧和受体侧均受到不同程度的影响。但是增施N
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|