第一作者:孙园园(1987-),女,黑龙江牡丹江人,在读硕士生,研究方向为植物生物技术与次生物质代谢。E-mail:sun.786@163.com
采用盆栽试验的方法,研究镉(Cd)胁迫对多花黑麦草( Lolium multiflorum)镉积累特性、生理抗性及叶片超微结构的影响。结果表明,1)在不同浓度Cd胁迫下,多花黑麦草地上部含Cd量小于临界值(100 mg·kg-1),且地上部含Cd量小于根部含Cd量,此外,转运系数小于1。2)低浓度Cd(50 mg·kg-1)胁迫下的多花黑麦草叶绿素含量升高,高浓度Cd胁迫抑制其合成。随Cd浓度增加,初始荧光强度(F0)逐渐升高,最大荧光强度(Fm)先升后降,光系统Ⅱ(PSⅡ)最大光化学量子产量(Fv/Fm)和PSⅡ的潜在光化学效率(Fv/F0)逐渐降低,光量子产量( ФPSⅡ)、电子传递效率(ETR)、光化学淬灭系数(qP)和非光化学淬灭系数(qN)均呈现先升后降的趋势。3)过氧化氢酶(CAT)的活性均表现出先降后升再降的趋势,超氧化物歧化酶(SOD)的活性呈现先升后降的趋势;与对照无Cd胁迫相比,过氧化物酶(POD)的活性大体上是升高的;脯氨酸的含量随Cd胁迫浓度增加而逐渐升高;Cd胁迫下多花黑麦草叶片丙二醛(MDA)含量升高不显著( P>0.05),其膜脂过氧化程度不高。4)高浓度Cd(300 mg·kg-1)胁迫对多花黑麦草叶肉细胞超微结构有所损伤,部分叶绿体空洞化,基粒片层溶解,线粒体嵴结构减少,嗜锇粒增多。研究发现,多花黑麦草对镉胁迫具有较强的积累能力及抗性,可用于镉污染土壤的修复。
The pot experiments were conducted to investigate effects of cadmium(Cd) stress on cadmium accumulation, physiological response and ultrastructure of Lolium multiflorum under different concentrations of Cd stress. The results showed that aboveground Cd content was less than the critical value (100 mg·kg-1) and underground Cd contents and the translocation factor was less than 1 which suggest that L. multiflorum is not Cd hyperaccumulator. The low concentrations (50 mg·kg-1) Cd stress stimulated the chlorophyll synthesis whereas high concentration Cd stress inhibited the chlorophyll synthesis. With Cd concentration increasing, the initial fluorescence (F0) gradually increased, the maximum fluorescence (Fm) firstly increased and then decreased, while photochemical efficiency of PSⅡ(Fv/Fm) and potential photochemical efficiency of PSⅡ (Fv/F0) gradually decreased, quantum yield (PSⅡ), electron transfer efficiency (ETR), photochemical quenching coefficient (qP), non photochemical quenching coefficient (qN) firstly increased and then decreased. The indices of physiological had different performance. With Cd concentration increasing, CAT activities firstly decreased and then increased and decreased again, however, superoxide dismutase activities firstly increased and then decreased and proline contents gradually increased. Compared with the control, POD activities increased, however, MDA contents had no significant increase which suggest that the leaves of L. multiflorum did not have high degree membrane lipid peroxidation. The high Cd concentration (300 mg·kg-1) injury ultrastructure of L. multiflorum which made part of the chloroplast grana lamellae hollowed, granum lamella dissoluted, mitochondrial cristae structure reduced and osmiophilic particles increased. This study indicated that L. multiflorum had stronger accumulated ability and physiological resistance to Cd stress and could be used in remidiation for Cd contaminated soil.
镉(Cd)主要来源于电镀、采矿、冶炼、燃料、电池和化学工业等排放的废水, Cd污染危害环境和人类健康, 被认为是全球最严重的环境问题之一[1]。在受污染土壤中生长的植物能够吸收和积累Cd等重金属, 植物可食组织构成了镉进入食物链的主要途径[2]。Cd一旦过量吸收就会干扰植物的生理代谢过程, 表现出叶色减褪、植物矮化、物候期延迟、生物产量下降等[3]。
多花黑麦草(Lolium multiflorum)又称一年生黑麦草, 为禾本科草本植物, 生长快, 再生性好, 产量高, 是重要的栽培牧草和绿化植物, 具有较高的经济价值, 且对重金属具有吸附性[4]。但有关多花黑麦草的Cd富集特征、生理生化特性及光合系统对Cd胁迫响应的研究报道较少。为此, 本研究探讨了多花黑麦草Cd积累特性、叶绿素荧光参数、叶绿素含量、抗氧化酶活性、脯氨酸含量及丙二醛含量对不同梯度Cd胁迫的响应, 揭示不同浓度Cd胁迫对多花黑麦草的Cd积累、生理抗性及叶肉细胞中超微结构的影响, 同时, 为耐Cd植物的筛选、修复Cd污染的土壤及环境治理提供一定的参考依据。
供试多花黑麦草种子购自丹农国际种子公司。供试土壤为购买的营养土, 其主要理化性状为:容重0.2~0.8 g· cm-3, 孔隙度54%~75%, 土壤中可溶性盐含量(Ec值)1~3.5 mg· cm-1, 氮、钾、磷总含量2%, pH 5.5~7.5, 有效态镉含量0.017 mg· kg-1。胁迫试验所用分析纯氯化镉(CdCl2· 2.5H2O)。
2014年3月15日至7月15日, 盆栽试验于温室内自然光照条件下培养, Cd胁迫处理设置5个梯度, 分别为0(CK)、50、100、200、300 mg· kg-1 , 每个处理3个重复, 每盆500 g土壤, 氯化镉配成的溶液用喷淋器均匀喷淋至盆装土壤中, 每盆直接移栽4株大小长势一致的土培两周的幼苗。砖红色塑料花盆作为盆栽容器, 花盆高度12.5 cm、上口直径14.5 cm、下口直径10.5 cm。试验期间不施加任何肥料, 每天采用称重浇水的方法定时为植物补水, 土壤含水量维持田间持水量的80%, 待盆栽多花黑麦草生长90 d左右植株生长旺盛时期取样进行生理生化指标的测定。
分别采集植物地下部(根)和地上部(茎、叶)两部分样品, 植物样品上的泥土等污物用自来水冲洗干净, 再用去离子水冲洗数次, 将水分沥去后于65 ℃烘箱中烘干至恒重。不同Cd胁迫下每盆植物的地上部及地下部样品分别称取0.5 g, 3次重复, 送由上海微谱化工技术服务有限公司测定Cd含量。转运系数=地上部分的重金属含量/地下部分的重金属含量[5]。
多花黑麦草经Cd处理90 d后, 其叶绿素荧光参数用LI-6400 XT配备荧光叶室6400-40测定。各处理每盆随机选择植株中上端功能健壮的叶片, 暗适应30 min后测定荧光指标, 包括初始荧光强度(F0)、最大荧光强度(Fm)、PSⅡ 的最大光化学效率(Fv/Fm)和PSⅡ 的潜在光化学效率(Fv/F0)。打开活化光, 1 000 μ mol· (m2· s)-1持续光照射20 min, 然后测定叶片荧光诱导动力学参数, 包括光合电子传递效率(ETR)、光量子产量(Ф PSⅡ )、光化学猝灭系数(qP)和非光化学猝灭系数(qN), 每次测定重复4次。
叶绿素含量测定按照陈毓荃[6]的方法, 丙二醛(MDA)含量按张志良等[7]的方法测定; 过氧化物酶(POD)活性测定按陈建勋等[8]的方法; 超氧化物酶(SOD)活性采用氮蓝四唑光化还原法[9]测定; 过氧化氢酶(CAT)活性测定按照李仕飞等[10]的方法测定; 脯氨酸含量测定采用酸性茚三酮法[7]。各处理下每盆植物样品分别测定, 各3次重复。
取各处理下多花黑麦草相同部位的叶片, 用去离子水洗净, 然后切成1 mm2大小的样块, 迅速置于3%戊二醛(0.1 mol· L-1PBS, pH 7.2~7.8)配置溶液中, 抽气直至材料下沉为止, 于4 ℃冰箱中固定24 h及以上。固定的材料用双蒸水冲洗, 乙醇系列脱水, 环氧树脂812, Power Tome PC型超薄切片机切片, 经柠檬酸铅和醋酸双氧铀染色后, 用JEM-1200EX透射电镜对其进行观察、拍照。
用Microsoft Excel 2007软件对试验数据进行整理, SPSS 19.0统计软件对整理后的数据进行分析, 差异显著性水平为0.05。超微结构图片用Photoshop CC进行处理。
Cd浓度在50~300 mg· kg-1, 多花黑麦草地上部和根中的Cd积累量随Cd处理浓度的增加均呈现递增的趋势(表1), 且Cd胁迫处理与对照间差异显著(P< 0.05)。在外界Cd浓度达到300 mg· kg-1时, 地上部植株含量为35.65 mg· kg-1, 而根中却高达418.5 mg· kg-1。多花黑麦草体内Cd含量分布特征表现为根部> 地上部。各处理Cd转运系数均小于1, 且比对照低, 其中100~300 mg· kg-1Cd胁迫下, 转运系数随Cd胁迫浓度的增加逐渐降低, 可见, 在不同浓度Cd胁迫下, 多花黑麦草的根系对Cd具有较强的富集能力, 但是其向地上部转移Cd的能力较弱, 此外, 地上部Cd含量小于超富集植物临界含量(100 mg· kg-1)[11], 因此, 多花黑麦草不具备Cd超积累植物的特征。
| 表1 Cd胁迫对多花黑麦草镉含量及转运系数的影响 Table 1 Effects of Cd stress on Cd contents and translocation factor of L. multiflorum |
2.2.1 Cd胁迫对多花黑麦草叶片叶绿素荧光参数的影响 50~300 mg· kg-1Cd胁迫使多花黑麦草的F0升高(表2), 且与对照间差异显著(P< 0.05), 说明Cd胁迫可能使多花黑草叶片的PSⅡ 反应中心的D1蛋白失活或降解。在50~300 mg· kg-1处理下, Cd胁迫使多花黑麦草的Fm升高, 且与对照间差异显著(P< 0.05), 表明低浓度Cd胁迫可以提高多花黑麦草的电子传递能力。在50~300 mg· kg-1Cd胁迫下的Fv/Fm和Fv/F0均低于对照, 但与对照间差异不显著 (P> 0.05), 说明Cd胁迫对多花黑麦草叶片的光化学效率影响较小。
| 表2 Cd胁迫对多花黑麦草叶片F0、Fm、Fv/Fm和Fv/F0的影响 Table 2 Effects of Cd on F0, Fm, Fv/Fm and Fv/F0 in leaves of of L. multiflorum |
2.2.2 Cd胁迫对多花黑麦草叶片叶绿素荧光诱导动力学参数的影响 在不同浓度Cd胁迫下, 多花黑麦草叶片的Ф PSⅡ 先升后降。在300 mg· kg-1胁迫下的Ф PSⅡ 最低(表3), 显著低于对照和50、100 mg· kg-1Cd胁迫处理(P< 0.05)。随Cd胁迫浓度的增加, 各处理间的ETR先升后降, 而qP一直下降, 但各处理间差异不显著(P> 0.05), 可见, Cd胁迫能够提高多花黑麦草的电子传递效率, 但作用不显著。qN随Cd胁迫浓度的增加呈现先升后降趋势, 其中300 mg· kg-1胁迫下qN值最低, 且显著低于50和100 mg· kg-1胁迫下的qN值(P< 0.05), 说明高浓度Cd胁迫可以减弱多花黑麦草的光保护能力, 不能将过剩的光能耗散为热。
| 表3 Cd胁迫对多花黑麦草叶片叶片Ф PSⅡ 、ETR、qP和qN的影响 Table 3 Effects of Cd on Ф PSⅡ , ETR, qP and qN in leaves of of L. multiflorum |
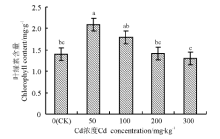
在0~300 mg· kg-1Cd胁迫下, 多花黑麦草叶绿素的含量先升后降, 其中50 mg· kg-1Cd胁迫下叶绿素的含量最大(图1), 比对照高50.36%, 与对照间差异显著(P< 0.05)。而300 mg· kg-1 Cd胁迫下的叶绿素含量最低且与对照差异不显著(P> 0.05)。由此可知, 在本研究条件下, Cd胁迫对多花黑麦草叶绿素的合成呈现低浓度促进作用、高浓度抑制作用, 但抑制程度不明显。
在0~300 mg· kg-1Cd胁迫下, 多花黑麦草的过氧化氢酶(CAT)活性呈现先降后升再降的趋势, 其中50 mg· kg-1胁迫下的CAT活性最低, 与对照相比, 显著降低了28.9%(P< 0.05)(图2)。0~200 mg· kg-1 Cd胁迫下的超氧化物歧化酶(SOD)活性没有显著变化, 但在300 mg· kg-1Cd胁迫下较对照显著降低了44.55% (图2)。对于过氧化物酶(POD)而言, 其活性在各浓度Cd处理下相比对照虽然略有升高, 但与对照间差异不显著(P> 0.05)(图2)。由此可知, 多花黑麦草的抗氧化酶系统对Cd胁迫产生了不同程度的生理响应, 可能有助于降低Cd胁迫对植物细胞的伤害。
与对照相比, 50~300 mg· kg-1 Cd胁迫下多花黑麦草的脯氨酸含量均升高(图3), 脯氨酸含量在3.57~23.66 mg· g-1 , 且100、200和300 mg· kg-1 Cd胁迫下的脯氨酸含量与对照间差异显著(P< 0.05)。由此可知, 中、高浓度Cd胁迫明显提高多花黑麦草叶片脯氨酸的含量, 可能有助于保护细胞的功能和结构免于Cd胁迫的伤害。
0~300 mg· kg-1 Cd 胁迫下多花黑麦草丙二醛(MDA)的含量随胁迫浓度增加呈现先升后降的趋势(图4), 在50 mg· kg-1 Cd胁迫下表现为最高, 但各处理与对照间差异不显著(P> 0.05)。这说明在Cd胁迫下, 多花黑麦草细胞膜的过氧化程度不高, 其结构损伤不大。
正常生长条件下, 多花黑麦草叶片超微结构, 叶肉细胞中叶绿体均分布于细胞边缘, 叶绿体形状为梭形或椭球形; 叶绿体双层膜和类囊体结构清楚, 基粒或基质片层结构清晰, 呈平行排列; 线粒体为椭圆形, 线粒体内嵴结构清晰, 可见被膜(图5)。然而, 在300 mg· kg-1 Cd胁迫下, 多花黑麦草叶片超微结构, 部分叶绿体形状发生明显膨胀, 由原来的椭圆形变成球形; 类囊体肿胀, 一些基质片层发生溶解, 基粒有些紊乱; 线粒体数目减少, 线粒体由原来的圆形变成椭圆形, 有的线粒体已失去完整的膜结构, 几乎与周围介质融合, 线粒体内嵴结构不清晰, 嵴分化或消失; 此外, 叶绿体中出现数量很多的嗜锇颗粒, 且有些嗜锇颗粒呈现相互聚集的趋势(图6)。这表明高浓度的Cd胁迫会造成多花黑麦草叶绿体结构的破坏, 加速其衰老。
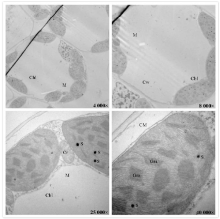 | 图5 对照处理下多花黑麦草叶片叶绿体和线粒体超微结构注:Chl 叶绿体; Gra, 基粒片层; M, 线粒体; Cr, 嵴; CW, 细胞壁; CM, 细胞膜; S, 嗜锇颗粒。图6同。Fig.5 Chloroplasts and mitochondria ultrastructure in leaves of L. multiflorum unde control conditionNote: Chl, chloroplast; Gra, grana sheet; M, mitochondria; Cr, crest; CW, cell wall; CM, membrane; S, osmiophilic particles. The same in Fig.6. |
Cd超积累植物同时具有3个特征:一是在同一生长条件下, 植物地上部(茎或叶)Cd含量是普通植物的100倍, 其Cd临界含量为100 mg· kg-1; 二是植物地下部Cd含量小于其地上部Cd含量; 三是植物的生长没有出现明显的毒害症状, 且对Cd具有较强的耐性[11]。大部分植物能够将重金属转移至植物地上地上部, 比如镉胁迫下丹参(Salvia miltiorrhiza)叶片和根系中Cd含量极显著增加[12, 13]。本研究结果表明, 在不同Cd处理下, 多花黑麦草植物体内Cd含量分布特征相同, 均表现为根部> 地上部, 其根系对Cd具有较强的富集能力, 但是其向地上部的转移Cd能力较弱, 这与其他研究者[14, 15]的结果类似。此外, 多花黑麦草地上部Cd含量均小于100 mg· kg-1, 因此, 多花黑麦草虽未达到Cd超积累植物的临界标准, 但植株生长过程没有明显的损伤, 属于耐Cd较强的植物, 在植物稳定修复中具有一定的应用价值。
随着Cd处理浓度的升高, 重金属破坏植物叶片中叶绿体结构, 使叶绿素含量降低[16]。有研究表明[17], Cd能够显著降低草地早熟禾叶绿素的含量。本研究结果表明, 低浓度Cd胁迫促进多花黑麦草叶片叶绿素的合成, 而高浓度Cd胁迫对叶绿素合成具有一定的抑制作用, 这与朱志勇等[18]高浓度Cd胁迫抑制小麦(Triticum aestivum)旗叶叶绿素合成的结果相类似。叶绿素荧光分析技术是研究植物生理状况, 探测植物与逆境胁迫关系的理想探针[19]。初始荧光(F0)是PSⅡ 反应中心处于完全开放时间的荧光产量, 其变化趋势可以反映引起光合机构变化的内在机制; 最大荧光(Fm)是PSⅡ 反应中心处于完全关闭时的荧光产量, 可反映通过PSⅡ 的电子传递情况; 可变荧光(Fv)反映可参与PSⅡ 光化学反应的光能辐射部分, 其变化能反映PSⅡ 活性的变化结果; Fv/F0和Fv/Fm分别代表PSⅡ 的潜在光化学效率和最大光化学效率, 其变化趋势可以反映光化学变化的内在机制[20]。研究表明, 在高浓度Cd胁迫下, 水稻(Oryza sativa)Fv/Fm、Ф PSⅡ 、qP、qN均显著下降[21]。本研究结果表明, 随Cd胁迫浓度的增加, 多花黑麦草的F0增大, Fm先升后降, Fv/Fm、Fv/F0逐渐降低, 表明高浓度Cd胁迫使多花黑麦草的PSⅡ 反应中心受损, 降低其电子传递能力。贾中民等[22]研究表明, 随Cd浓度的增加, 枫杨(Pterocarya stenoptera)幼苗的Ф PSⅡ 、ETR、qP、qN逐渐下降。本研究结果表明, 随Cd胁迫浓度的增加, 多花黑麦草的Ф PSⅡ 、ETR、qP、qN均呈现先升后降的趋势, 表明高浓度Cd胁迫降低多花黑麦草叶片的光合能力和散热能力。植物细胞遭受重金属胁迫后其细胞器会发生不同程度的损伤, 主要表现为叶绿体、线粒体、液泡、质膜等发生异常变化[23]。如Cd胁迫可以使玉米(Zea mays)叶绿体膨大, 类囊体排列不规则, 细胞器损伤严重甚至解体[16]。在Cd胁迫下, 水稻叶肉细胞中叶绿体空泡化, 部分线粒体出现肿胀甚至解体[24]。本研究结果表明, 未经Cd胁迫处理下多花黑麦草叶肉细胞中叶绿体为梭形或椭球形, 主要分布于细胞边缘, 基粒或基质片层结构清晰, 且按一定顺序平行排列, 膜被有内膜和外膜组成。线粒体为球形, 有膜被, 嵴结构清晰。而在高浓度Cd胁迫下, 多花黑麦草叶肉中大部分叶绿体为椭球形, 小部分叶绿体空泡化, 嗜锇颗粒增多。线粒体数目减少, 线粒体内嵴结构减少, 膜被尚可见。可知, 高浓度Cd胁迫对多花黑麦草叶片超微结构有一定程度上的损伤, 但低浓度Cd胁迫有利于其光合作用。
在逆境条件下, 植物细胞内产生和清除自由基的平衡被破坏, 自由基增加, 而植物的生长对轻微逆境具有一定的适应性, 主要表现为超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)的活性增加[25]。本研究结果表明, 在不同梯度Cd胁迫下, 多花黑麦草叶片抗氧化酶产生不同程度的生理响应, 表明多花黑麦草对Cd胁迫的固有调节能力, 以降低Cd胁迫对植物细胞的伤害, 这与杨卫东等[26]的结果一致。在逆境胁迫下, 植物体内一种生理生化反应表现为游离脯氨酸含量的增加, 脯氨酸是一种细胞质渗透调节物质, 能够稳定生物大分子结构, 游离脯氨酸积累可防止植物细胞结构和功能受损伤, 使其伤害程度降低, 此外, 活性氧自由基可以被清除[26]。本研究结果表明, 多花黑麦草叶片脯氨酸含量随Cd胁迫浓度的增加而逐渐在体内积累, 这是对逆境胁迫的一种适应性反应, 这与前人[27, 28, 29]的结果类似。在逆境条件下, 丙二醛作为植物膜脂过氧化产物, 其含量能够指示植物体内脂类过氧化程度, 植物的抗性通常与其体内丙二醛含量呈负相关[30]。本研究结果表明, Cd处理下多花黑麦草叶片丙二醛含量升高不显著, 其膜脂过氧化程度不高, 结构损伤不大。
综上所述, 在不同梯度Cd胁迫下, 多花黑麦草体内Cd含量均表现为地下部> 地上部的分布特征, 根系积累Cd能力较强, 且在植株生长过程没有出现明显的毒害症状, 因此, 可用其提取重金属污染土壤中的Cd。同时, 多花黑麦草叶片抗氧化酶、脯氨酸、丙二醛对Cd胁迫产生不同程度的生理响应, 可以看出多花黑麦草对Cd胁迫具有一定的生理适应能力, 以降低Cd胁迫对植物细胞结构和功能的伤害。此外, 高浓度Cd胁迫在一定程度上损伤多花黑麦草叶片的超微结构, 但低浓度Cd胁迫有利于其光合作用。因此, 多花黑麦草若广泛应用于城市的绿化建设, 不仅可以美化环境, 也具有修复重金属污染土壤的应用潜力。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|