以表达二穗短柄草( Brachypodium distachyon) CBF2基因的拟南芥( Arabidopsis thaliana)为材料,通过模拟干旱胁迫分析其种子和幼苗对甘露醇渗透胁迫的响应和成苗对盆栽条件下水分胁迫的响应。结果表明,渗透压为-0.62 MPa时种子萌发率开始下降,转基因拟南芥种子萌发率略高于野生拟南芥,但差异不显著( P>0.05)。以根的增长量作为评价幼苗抗旱性的主要标准,当渗透压小于-0.37 MPa时,根长增长量随着胁迫强度的增加而明显减小,转基因株系根长增长量始终显著高于野生型拟南芥( P<0.05)。拟南芥成苗干旱胁迫至25 d,野生拟南芥成活率为11.7%,转基因植株平均成活率为41.6%;随着干旱胁迫时间的延长,转基因拟南芥过氧化物酶、超氧化物歧化酶活性均显著高于野生植株,丙二醛含量及相对电导率显著低于野生植株。结果表明,二穗短柄草 CBF2基因提高了拟南芥幼苗及成苗的抗旱性。
The Arabidopsis thaliana expressing CBF2 gene in Brachypodium distachyon was used as the experimental material. The response of the germination rate of transgenic A. thaliana seeds and seedlings growth to drought was analyzed by simulated mannitol osmotic stress, and the drought resistance of the mature seedlings was detected by pot experiments. Results showed the seed germination rate declined with the increase of the osmotic pressure, and it become significant when it reached -0.62 MPa. The germination rate of transgenic seed was slightly higher than wild seeds, but the difference was not significant. When the osmotic pressure was higher than -0.37 MPa, the root length increment significantly reduced with the increase of stress intensity, and the root length increment of transgenic plants was significantly higher than wild A. thaliana. The survival rate of wild A. thaliana was 11.7%, while the average survival rate of transgenic plants was 41.6% when the A. thaliana seedlings was dealing with drought stress for 25 days. POD and SOD activity of transgenic A. thaliana was significantly higher than wild plants, and MDA content and relative electrical conductivity were significantly lower than wild plants with the extension of drought stress time. Our results suggested that the CBF2 gene in B. distachyon can significantly enhanced the drought resistance of transgenic A. thaliana seedlings and mature seedlings.
干旱是影响植物生长的重要环境因子之一, 也是对全球影响最广泛的自然灾害[1]。我国是一个干旱灾害频发的国家, 据统计每年我国干旱灾害造成的损失超过各种自然灾害损失总和的15%[2, 3]。因此, 提高植物的抗旱性在育种工作中尤为重要。随着分子生物学与基因工程技术的不断发展, 基因工程技术成为改良植株抗旱性、培育抗旱新品种的重要途径之一。相比功能基因, 转录因子在一定条件下可以调控多个逆境相关基因的表达, 因此, 利用转录因子来提高植株的抗逆性将是一条更有效的途径[4]。AP2、bZIP、NAC、MYB、Cys2/His2锌指等不同类型的转录因子能够调控植物应答干旱胁迫, 这些转录因子通过激活或抑制下游干旱应答基因的表达来调节植物的抗旱性, 且能获得持久的抗逆性, 具有广阔的应用前景[5, 6, 7, 8, 9]。
DREB/CBF(dehydration responsive element binding protein/C-repeat binding factor)属于AP2类转录因子, 被称为低温反应转录因子。CBF基因家族目前发现编码6个相关的转录活化因子, 分别称为CBF1、CBF2、CBF3、CBF4、CBF5和CBF6[10, 11]。当某些植物受到干旱、盐碱、冷胁迫时DREB/CBF上调表达, 可激活其它一系列依赖DRE/CRT顺式作用元件的抗逆功能基因的表达, 从而增强植物对干旱、低温及高盐碱等逆境的抗性, 例如在拟南芥(Arabidopsis thaliana)中超表达的CBF4激活了包含低温驯化及干旱适应的下游基因C-重复/脱水应答元件, 从而提高了植株的抗寒性、抗旱性[10, 12]。目前, CBF家族转录因子抗寒功能及应用的研究比较广泛, 研究表明, DREB/CBF基因的表达可以被多种胁迫诱导, CBF1及CBF3多在盐胁迫下表达, 而CBF2主要在干旱及高盐胁迫下表达[13, 14]。通过对干旱胁迫时CBF 4种基因在不同葡萄(Vitis vinifera)品种中表达模式的研究发现, 干旱条件下CBF2在叶片及根系中均表达, 且相比衰老组织, 幼嫩组织中的表达量较多[15, 16]。此外, 受ABA的诱导, CBF2的表达量也会增加, 原因是植物对ABA的响应促进了CBF启动子活性的提高[12, 17, 18]。CBF2在CBF1和CBF3表达上具有负的调控作用, 并且对拟南芥的耐胁迫性起着重要作用[18]。
二穗短柄草(Brachypodium distachyon)是禾本科短穗草属一年生野生草本植物, 具有极强的抗寒性, 对干旱、盐碱也有一定的抗性[19]。目前已证明, 二穗短柄草CBF3转录因子在提高植物的抗寒性方面具有重要作用[20], 但对二穗短柄草CBF2转录因子抗性的研究较少。本研究以已转入二穗短柄草CBF2基因的拟南芥为研究材料, 通过对比干旱胁迫条件下转基因拟南芥与野生植株形态及生理指标的差异, 探讨该基因对干旱的抗性, 从而为该基因的抗旱性应用及基因作用机理等研究奠定基础, 同时也为培育抗旱新品种提供新思路。
二穗短柄草CBF2转基因拟南芥T3代种子T3-3、T3-6、T3-9为试验材料, 以野生拟南芥(WT, 由加州大学戴维斯分校Blumwald Eduardo教授赠送的种子的后代)为对照。
1.2.1 种子消毒 取适量拟南芥种子(储存在4 ℃的冰箱中以保证发芽整齐)至离心管中, 先用75%酒精消毒30 s, 无菌水冲洗一次, 再用5%的次氯酸钠消毒12 min, 无菌水冲洗3次。
1.2.2 种子渗透胁迫处理 将已消毒的转基因和野生拟南芥种子, 播于渗透压分别为0、-0.12、-0.25、-0.37、-0.49、-0.62、-0.74 MPa的1/2MS培养基上, 放入培养箱(23~24 ℃)中暗培养3 d, 后置于光照培养室培养, 每个处理重复3次, 20 d后统计不同浓度甘露醇下转基因和野生拟南芥种子的萌发率。
萌发率=萌发种子数/播种种子总数× 100%。
1.2.3 幼苗的渗透胁迫处理 将在1/2MS培养基培养7 d的转基因与野生拟南芥幼苗移入渗透压分别为0、-0.12、-0.25、-0.37、-0.49、-0.62、-0.74 MPa的1/2MS培养基上, 每个处理重复3次, 垂直培养10 d后, 测量不同浓度甘露醇处理下转基因和野生幼苗的根长增长量。
根长增长量=垂直培养10 d后主根长度-垂直培养10 d前主根长度。
1.2.4 成苗的干旱胁迫处理 当幼苗长出4片真叶时将其移入花盆中(培养基质为营养土:蛭石=1:1), 放入长日照培养室中培养。培养30 d后, 停止浇水, 每4 d观察记录转基因和野生拟南芥的形态变化, 24 d时统计其成活率。
成活率=成活植株株数/移栽植株总株数× 100%。
1.2.5 干旱胁迫处理转基因拟南芥成苗的生理指标测定 分别取干旱处理0、4、8、12、20 d的转基因和野生拟南芥成苗叶片为待测样品, 每份待测样品取自于一株植物, 每个处理重复3次, 即每个处理取3株植物。采用氮蓝四唑(NBT)光化还原法测定超氧化物歧化酶(SOD)总活性, 采用愈创木酚法测定过氧化物酶(POD)总活性, 采用硫代巴比妥酸法测定丙二醛(MDA)含量, 采用电导仪法测定电导率[21]。
采用Excel整理数据, 使用SPSS软件对每个测定指标进行单因素方差分析, 然后对同一胁迫条件下不同株系间的数据进行多重比较。
当渗透压为0、-0.12、-0.25、-0.37、-0.49 MPa时, 转基因和野生型拟南芥种子萌发率均为100%(图1)。当渗透压达-0.62 MPa时, 野生型拟南芥种子平均萌发率降至76.4%, 转基因拟南芥T3-3、T3-6、T3-9的种子平均萌发率分别为89.3%、93.1%和95.7%(图1), 但转基因株系与野生型差异不显著(P> 0.05)。而此时已萌发的野生型拟南芥与转基因拟南芥株系表型差异明显, 野生型拟南芥幼苗较转基因幼苗更小, 且叶片数量少。转基因拟南芥株系T3-3、T3-6、T3-9之间种子萌发率和表型均无明显差异。当渗透胁迫达-0.74 MPa时, 野生型拟南芥种子萌发率降为33.3%, 而转基因拟南芥株系T3-3、T3-6、T3-9的种子萌发率分别为38.7%、37.1%和39.0%, 转基因与野生型相比差异仍不显著。因此, 转基因拟南芥在种子萌发阶段并未表现出明显强于野生型的抗旱能力。
 | 图1 甘露醇渗透胁迫对转基因和野生型拟南芥萌发率的影响注:不同字母表示同一胁迫条件下不同植株材料间差异显著(P< 0.05)。WT, 野生型拟南芥; T3-3, T3-6和T3-9为转基因型拟南芥。图2同。Fig.1 Germination percentage of transgenic and wild type A. thaliana with different osmotic pressureNote: Different lower case letters under the same stress condition indicate significant difference among different plant materials at 0.05 level. WT, wild A. Tthaliana; T3-3, T3-6 and T3-9 are transgenic A. thaliana. The same in Fig.2. |
当渗透压为-0.25 MPa时, 转基因拟南芥幼苗的根长增长量与未干旱胁迫下幼苗相比差异不显著(P> 0.05), 野生型幼苗根长增长量明显下降, 其根长增长量显著低于同一渗透压下的转基因幼苗(P< 0.05)(图2)。当渗透压为-0.37、-0.49、-0.62、-0.74 MPa时, 根长增长量随着渗透胁迫的增强而明显减小, 转基因株系的根长增长量始终显著高于野生型拟南芥的(P< 0.05)(图2)。而在渗透压-0.49、-0.74 MPa时, 转基因株系T3-3的根长增长量显著低于转基因株系T3-6和T3-9的(P< 0.05)。随着渗透胁迫的增强, 以未进行干旱胁迫的幼苗为对照, 转基因与野生拟南芥幼苗根增长量不断减少, 植株形态差异不明显。表明, CBF2基因在一定程度上增强了转基因拟南芥在幼苗期的抗旱能力, 且转基因株系T3-6和T3-9相对于株系T3-3的基因表达性状更稳定。
水分胁迫结果表明, 干旱8 d时, 野生型拟南芥表型开始发生变化, 其植株叶片开始失绿、变黄, 而转基因拟南芥各株系正常生长(图3)。此后8-20 d, 随着处理时间的增长, 转基因与野生型拟南芥生长状态皆下降, 叶片渐枯、萎蔫, 至处理20 d时, 转基因与野生型拟南芥皆已出现死亡植株, 此时野生型拟南芥的枯黄现象更为严重, 与转基因各株系之间具有一定的表型差异(图3)。24 d时统计成活率, 野生型拟南芥的成活率仅为11.7%, 而转基因拟南芥各株系T3-3、T3-6和T3-9株系成活率分别为38.3%、44.5%和41.9%。表明CBF2基因在增强转基因拟南芥植株抗旱性方面具有一定的作用。
2.4.1 干旱胁迫对超氧化物歧化酶(SOD)及过氧化物酶(POD)总活性的影响 随着干旱胁迫时间的延长, 转基因各株系和野生型拟南芥的SOD、POD活性均呈现先升高后降低的趋势, 未处理时各株系间酶活性差异不显著(P> 0.05)(图4、5)。胁迫至8 d, 转基因与野生拟南芥SOD、POD的活性达到最高, 随后活性降低, 可能是干旱胁迫下拟南芥启动了其胁迫响应机制。与野生拟南芥相比, 转基因植株SOD、 POD活性始终略高于野生型植株内酶活性, 但差异不显著。
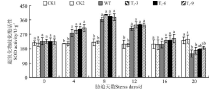 | 图4 干旱胁迫对转基因和野生型拟南芥SOD的影响注:CK1为野生型未处理植株, CK2为转基因株系T3-9未处理植株。图5、6、7同。Fig.4 SOD activity of transgenic and wild type A. thaliana under drought stressNote: CK1 represent wild type A. thaliana of normal growth, CK2 represent T3-9 transgenic A. thaliana of normal growth. The same in Fig.5, Fig.6, Fig.7. |
 | 图5 干旱胁迫对转基因和野生型拟南芥POD的影响Fig.5 POD activity of transgenic and wild type A. thaliana under drought stress |
2.4.2 干旱胁迫对丙二醛含量的影响 随着干旱胁迫时间的不断延长, 转基因各株系和野生型拟南芥的丙二醛(MDA)含量均呈现不断升高的趋势(图6)。处理8-20 d内, 转基因拟南芥MDA含量始终显著低于野生型拟南芥植株(P< 0.05)。在干旱胁迫下, 转基因拟南芥的细胞膜质过氧化程度始终显著低于野生型拟南芥, 间接说明转基因植株内产生的超氧负离子更少, 干旱胁迫使其受害的程度更小。CBF2基因能够减缓植物呼吸平衡的破环, 即提高了植株的抗旱性。
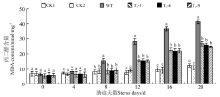 | 图6 干旱胁迫对转基因和野生型拟南芥MDA的影响Fig.6 MDA content of transgenic and wild type A. thaliana under drought stress |
2.4.3 干旱胁迫对电导率的影响 随着干旱胁迫时间的延长, 转基因各株系和野生型拟南芥的相对外渗电导率均不断升高(图7)。胁迫8-20 d内, 转基因各株系电导率均显著低于野生型拟南芥(P< 0.05)。与野生拟南芥相比, 转基因拟南芥各株系的相对电导率上升趋势更平缓, 说明转基因拟南芥细胞膜结构稳定性更好, 膜结构受到的功能破坏更小, 即转基因拟南芥抗旱性提高。
在干旱环境下, 种子能否保持活力及幼苗能否继续生长是植物存活的关键, 目前对转基因植株种子萌发期的抗性研究较少, 而种子萌发期抗旱性鉴定是整体抗旱性评价的重要内容[22, 23, 24]。渗透调节是植物适应水分胁迫的主要生理机制, 通过渗透调节植物在干旱条件下维持一定的膨压, 从而维持细胞生长、气孔开放和光合作用等生理过程的进行[25]。本研究对种子及幼苗抗性的研究采用渗透调节模拟干旱的方法, 研究发现, 干旱胁迫下CBF2转基因拟南芥的种子萌发率略高于野生拟南芥的, 但差异不显著, CBF2基因在改善拟南芥种子的抗旱性上, 没有表现出明显优势。干旱胁迫下, 幼苗根的生长对植物幼苗生长发育具有十分重要的意义[26]。因此, 本研究以根长增长量作为分析幼苗抗旱性的主要指标。当渗透压达-0.25 MPa时, 转基因拟南芥各株系根长增长量皆显著高于野生型(P< 0.05), 转基因拟南芥显示出较强的抗旱性, 即CBF2基因增强了植株幼苗时期的抗旱能力。
对转基因与野生拟南芥成苗进行相同时间的水分胁迫, 胁迫8和20 d时转基因拟南芥各株系与野生型拟南芥表型差异明显, 24 d时统计成活率, 野生拟南芥成活率为11.7%, 转基因不同株系的平均成活率为41.6%。胁迫条件下, 细胞及酶活性变化以及渗透调节物质累积情况需要依靠植物的生理生化指标进行研究[27]。干旱胁迫打破了植物细胞中活性氧产生与清除之间的平衡, 导致活性氧积累, 引起膜脂过氧化作用[28]。POD、SOD是植物体内清除活性氧的关键酶, 可以减轻或避免活性氧对细胞的伤害。本研究中, 转基因及野生各株系在干旱胁迫下POD、SOD活性均表现出先升高后下降的趋势, 胁迫至8 d, POD、SOD活性达到最高, 表明8 d后抗氧化酶防止膜脂过氧化和保护膜系统的能力降低[29]。转基因各株系POD、SOD的活性在胁迫8-20 d内显著高于野生植株, 表明转基因植株中清除活性氧的能力较强。MDA含量及相对电导率表明逆境对植株的伤害程度, 有研究表明[30, 31]MDA的含量、相对电导率的大小与植物抗旱系数呈线性负相关, 本研究中, 转基因株系的MDA含量与外渗电导率显著低于野生植株(P< 0.05)的, 表明转基因植株细胞膜遭受的破坏较小。综上所述, CBF2基因在提高拟南芥成苗抗旱能力上发挥了作用, 与李新玲等[31]对CBF2基因研究结果类似。
此外, 转基因拟南芥不同株系之间抗旱性也存在差异, T3-3株系的抗旱性较其它株系较弱。如干旱胁迫下, T3-3的根长增长量明显低于转基因株系T3-6和T3-9的, 原因可能是转基因株系T3-6和T3-9相对于株系T3-3基因表达性状更稳定。
对已转入二穗短柄草CBF2基因的拟南芥种子、幼苗及成苗进行干旱胁迫处理, 结果表明, 转基因拟南芥的抗旱性在幼苗及成苗期得到了提高, 即CBF2具有提高植株抗旱性的功能, 为研究CBF2基因其它功能奠定了基础, 也为利用转基因综合改良观赏植物的抗逆性提供了新思路。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|





