第一作者:赵翀(1991-),女,重庆万州人,在读硕士生,主要从事环境微生物研究。E-mail:zcsuzee@126.com
以新疆塔里木盆地的光果甘草( Glycyrrhiza glabra)和胀果甘草( G. inflate)为研究对象,采用变性梯度凝胶电泳(PCR-DGGE)技术研究甘草内生真菌的多样性及群落结构。结果显示,光果甘草和胀果甘草间及同一种类不同组织间的内生真菌多样性和群落结构均存在明显差异。其中,胀果甘草根(B1)的内生真菌多样性最丰富,光果甘草果(L4)的内生真菌多样性最差。对DGGE条带进行回收测序,共获得25条序列,归于枝顶孢属( Acremonium)、绿僵菌属( Metarhizium)、绿僵虫草属( Metacordyceps)、镰刀菌属( Fusarium)、链格孢属( Alternaria)、枝孢属( Cladosporium)、锤舌菌属( Leotiomycetes)、链格孢属( Alternaria)、帚枝霉属( Sarocladium)、假裸囊菌属( Pseudogymnoascus)、曲霉属( Aspergillus)11个真菌属,其中链格孢属为优势菌属,占总数的32%。甘草根、茎、叶、果、皮组织的内生真菌存在丰富的多样性,其中根与茎组织多样性最丰富。研究结果表明,新疆塔里木盆地药用植物甘草蕴藏着丰富的内生真菌资源,可作为一种较理想的分离内生真菌的植物来源。
In the present study, denaturing gradient gel electrophoresis (DGGE) was employed to analyze the community structure and diversity of endophytic fungi of Glycyrrhiza inflate and G. glabra plants in Tarim basin, Xinjiang.The results showed that diversity and community structure of endophytic fungi of Liquorice were different either in different species or in different tissue of the same species. The diversity of endophytic fungi was richest in root (B1) of G. inflate and lowest in the fruit of G. glabra. Twenty five gel bands were purified and sequenced which belonged to eleven genera, including Acremonium, Metarhizium, Metacordyceps, Fusarium, Alternaria, Cladosporium, Leotiomycetes, Sarocladium, Pseudogymnoascus, Aspergillus. Alternaria was dominant genera accounting for 32% of all sequences. All of the results revealed there was high diversity of endophytic fungi in the plant tissues of Liquorice and there was abundant endophytic fungi resource in Liquorice of Tarim basin, Xinjiang.
甘草为豆科甘草属(Glycyrrhiza)多年生草本植物, 喜干燥气候, 耐寒, 多生长于干旱、半干旱的荒漠草原, 是新疆荒漠区最主要的植被物种之一[1], 具有防风固沙、保持水土的作用[2]。胀果甘草(Glycyrrhiza inflate)和光果甘草(G. glabra)是塔里木盆地具代表性的甘草种类[3], 国内外已对甘草的化学成分, 药理作用开展了广泛的研究[4, 5, 6, 7], 表明甘草含有黄酮类化合物, 具有保肝、抗炎、抗菌、抗病毒、镇咳、抗疟、抗氧化、抗癌、免疫调解、降糖和抗血小板凝集等多种活性。内生真菌(endophytic fungi)是指在其生活史的某个阶段或全部阶段生活在植物组织内, 其存在不会引起植物病害症状的真菌[8]。由于内生真菌长期以来以寄生或共生等方式与宿主植物共存, 特别是内生于某些药用植物中的真菌, 在与宿主植物协同进化的过程中, 参与到药用植物的新陈代谢或某类活性化合物的合成过程, 而能产生相同或相似的化合物[9], 是获得新天然产物的重要来源[10, 11, 12, 13]。近年来, 多数研究者均以可培养方法分析甘草内生真菌的组成, 但由于传统分离方法的局限性而缺少对不同类型甘草内生真菌群落的全面了解。因此, 了解甘草内生真菌类群组成, 对合理开发利用甘草内生真菌资源具有重要意义。本研究采用变性梯度凝胶电泳(PCR-DGGE)技术结合DNA测序技术对新疆塔里木盆地光果甘草和胀果甘草内生真菌多样性及群落结构进行分析, 探究不同种不同组织间甘草内生真菌多样性的差异, 深入挖掘甘草药材中的微生物资源, 为潜在的抗病资源的筛选提供理论依据。
从塔里木盆地(40° 33'51″ N, 80° 19'55.3″ E)采集光果甘草和胀果甘草植物样品, 放入无菌塑料袋中, 4 ℃保存。
1.2.1 植物样品表面消毒 将样品分成根、茎、叶、果实、皮5个部分, 按照Hallmann等[14]的方法进行表面消毒。将处理好的样品用无菌滤纸吸干植物组织表面的水, 用无菌粉碎机把植物组织粉碎后备用。同时取0.2 mL 最后一遍清洗植物样品的水涂布于PDA 固体培养基上, 28 ℃ 培养3~7 d, 观察是否有菌长出, 进行消毒效果检测。
1.2.2 样品总DNA提取和18S rRNA PCR扩增 采用小量法[15, 16]提取样品总DNA后, 置于-20 ℃保存备用。采用巢式PCR对目标片段进行扩增。第1轮PCR扩增引物为ITS1-F(CTTGGTCATTTAGAGGAAGTAA)和ITS4(TCCTCCGCTTATTGATATGC)[17]。反应体系(20 μ L):Mix缓冲液10 μ L, 引物(10 μ mol· L-1)各0.2 μ L, 模板DNA 1 μ L, ddH2O补足20 μ L。第2轮PCR扩增引物为ITS1-F(CTTGGTCATTTAGAGGAAGTAA)和ITS2-GC(GCTGCGTTCTTCATCGATGCGCCGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG)[17]。反应体系(50 μ L):Mix缓冲液25 μ L, 引物(10 μ mol· L-1)各0.5 μ L, 第1轮PCR产物1 μ L, ddH2O补足50 μ L。同时设置不添加模板的阴性对照。为减少非特异性产物, 采用Touch-down PCR程序, 第1、2轮反应程序均为:95 ℃预变性6 min, 94 ℃变性1 min, 65-55 ℃退火45 s(每个循环温度降低0.5 ℃), 72 ℃延伸45 s, 共20个循环, 然后在其它条件不变的情况下, 在55 ℃的退火温度下扩增15个循环结束后, 72 ℃延伸10 min, 产物于4 ℃恒温保存。最后将PCR产物用1.0%琼脂糖凝胶电泳检测片段大小。
1.2.3 PCR产物变性梯度凝胶电泳 DGGE(聚丙烯酰胺凝胶电泳)在Dcode系统(Bio-Rad)上进行, 聚丙烯酰胺凝胶浓度为8%, 变性剂梯度浓度范围为30%~60%, 其变性方向与电泳方向一致。在1× TAE缓冲液中, 50 V预跑30 min, 然后160 V, 60 ℃恒温恒压电泳5.5 h。电泳完毕后将剥离的聚丙酰胺凝胶置于EB(0.5 μ g· mL-1)溶液中染色15 min, 然后在Bio-Rad凝胶成像系统下成像[18, 19]。
1.2.4 PCR-DGGE图谱分析 采用Quantity One分析软件(Bio-Rad)对光果甘草和胀果甘草各组织样品DGGE图谱电泳条带进行多样性分析。多样性指数(H)、丰富度(S)、辛普森指数(D)、优势度指数(C)[20, 21, 22]等指标被用来比较各个植物样品的内生真菌多样性。其中, H用于描述种群的个体出现紊乱和确定性, 不确定性越高, 多样性就越高。D是指群落中种数越多, 各种个体之间分配就越均匀, 指数越高, 多样性就越好。C也可以在一定程度上反映样品的多样性。
H=-∑ (Pi)· (lnPi);
D=1-∑
C=-∑
式中:Pi是某个植物样品中单一条带的强度在该样品中所有条带强度的比率, S是某个植物样品中所有条带数目的总和[23]。
1.2.5 DGGE条带测序和系统发育分析 将DGGE条带中的优势条带和特异性的条带切割下后, 用无菌去离子水清洗3次, 挑取一小块胶(胶块体积< 1 mm3)作 DNA模板。用第2次PCR扩增时用的引物(无GC发夹)进行PCR扩增, 体系和程序也与总DNA的18S rRNA PCR扩增时相同。PCR产物用UNIQ-10 DNA纯化试剂盒(上海生工)进行纯化, 然后用大连宝生物公司的pMDTM19-T Vector试剂盒进行克隆。挑选白色克隆子进一步测序, 测序由上海生工生物工程公司完成。将所测的序列, 以及通过 BLAST程序在GenBank获取的相似度较高的序列, 先用Clustral X(Version 1.81)进行全序列比对[24], 然后采用Neighbor-joining方法在Mega 5.0中进行系统发育分析[25]。将测序得到的序列提交GenBank数据库, 登录号为KU050708-KU050732。
1.2.6 数据分析 采用Quantity One分析软件(Bio-Rad)分析DGGE图谱, 所得数据采用Excel 2013进行统计分析和表格制作, 多样性指数、丰富度、优势度指数和辛普森指数的方差分析采用SPSS 20.0。
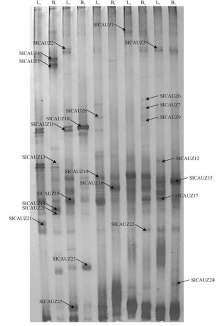
甘草各组织DNA的PCR产物在经过DGGE后, 分离出数目不等和迁移率存在明显差异的电泳条带(图1), 揭示了甘草内生真菌的多样性。通过比较胀果甘草根、茎、叶、果、皮的DGGE条带, 发现胀果甘草根组织的条带最多, 且最复杂, 茎组织次之, 皮组织的条带最少。表明同一种植物不同的部位其内生真菌多样性存在明显的差异, 且不同部位内生真菌的丰富度也有一定的区别。此外, 比较光果甘草和胀果甘草内生真菌的DGGE条带数, 发现茎、叶、皮组织样品的条带数均为光果甘草比胀果甘草多, 而根、果组织的DGGE条带数胀果甘草比光果甘草多, 表明不同种植物间各组织内生真菌多样性不同。
本研究依据电泳图谱中条带的强度, 以及各样品中真菌的H、S、D和C指标进行遗传多样性分析(表1)。
| 表1 植物组织样品中 DGGE 条带多样性指数、丰富度、优势度指数和辛普森指数 Table 1 Shannon-Wiener index(H), Richness(S), Dominance index(C), Simpson index(D) for the test plant samples |
微生物群落的遗传多样性在一定程度上可以通过DGGE条带的多少反映出来[26]。胀果甘草根(B1)内生真菌多样性指数(3.25)、丰富度(26)和辛普森指数(0.961)最高, 而光果甘草果(L4)和胀果甘草皮(B5)的丰富度和辛普森指数最低(表1)。优势度最高的是光果甘草果(L4)和胀果甘草皮(B5), 均为0.102, 最低的是胀果甘草根(B1), 为0.039。从甘草各组织的多样性看, 光果甘草内生真菌多样性大致体现出茎(L2)> 根(L1)> 叶(L3)> 皮(L5)> 果(L4)的分布规律, 而胀果甘草内生真菌多样性则是根(B1)> 茎(B2)> 叶(B3)> 果(B4)> 皮(B5)。将光果甘草与胀果甘草内生真菌多样性相比较后, 发现胀果甘草根和果内生真菌多样性明显高于光果甘草, 而茎、叶、皮内生真菌多样性则是光果甘草高于胀果甘草。表明植物种类和部位的不同都会导致其内生真菌群落结构的差异。
从10个样品的DGGE图谱中成功回收了25个条带(图1), 对DNA经PCR扩增、克隆后送上海生工生物工程有限公司测序, 将结果与Genbank数据库中的序列进行blast比对, 找出同源性最高的序列。结果表明, 所有回收条带的序列与数据库中的模式菌株都具有一定的同源性, 最高相似度在98%~100%(表2)。镰刀菌属(Fusarium)、链格孢属(Alternaria)、曲霉属(Aspergillus)、枝顶孢属(Acremonium)在不同品种不同组织部位中均有分布, 是甘草内生真菌的共有菌属。而有一些真菌菌属只存在于唯一的样品中, 如枝孢属(Cladosporium)只在胀果甘草的根部存在, 绿僵菌属(Metarhizium)只在光果甘草和胀果甘草的根部存在, 表明在不同种类的植物中存在特有的内生真菌类群。
| 表2 DGGE 切胶条带序列比对结果 Table 2 Phylogenetic identification and distribution of fungi excised and sequenced from DGGE bands |
系统发育树显示(图2), 可以将所有序列大致分为两个簇, 其中第1个簇又可以分为5个小支, SICAUZ 6、7、11、13、14、18、21、22、23、25聚在一支, 归于肉座菌目(Hypocreales)的丛赤壳科(Nectriaceae)和麦角菌科(Clavicipitaceae)两个科的枝顶孢属(Acremonium)、帚枝霉属(Sarocladium)、镰刀菌属(Fusarium)、绿僵菌属(Metarhizium)4个属; SICAUZ20聚在第2支, 归于粪壳菌目(Sordariales)毛壳菌科(Chaetomiaceae)梭孢壳属(Thielavia); SICAUZ 19聚在第3支, 归于煤炱目(Capnodiales)枝孢科(Cladosporiaceae)枝孢属(Cladosporium); SICAUZ1、2、10则聚在第4支, 归于散囊菌目(Eurotiales)曲霉科(Aspergillaceae)曲霉属(Aspergillus); SICAUZ16、17聚在第5支, 归于锤舌菌纲(Leotiomycetes)的锤舌菌属(Leotiomycetes)和假裸(Pseudogymnoascus)两个属。而第2个簇的序列则归于格孢菌目(Pleosporales)格孢腔菌科(Pleosporaceae)链格孢属(Alternaria)。其中链格孢属(Alternaria)占32%, 属于甘草内生真菌的优势种群, 说明甘草内生真菌具有丰富的多样性。
中国药典收载作为药用的主要是乌拉尔甘草(G. uralensis)、黄甘草(G. kansuensis)、胀果甘草和光果甘草[27]。目前, 有关甘草内生真菌多样性的研究仅见于对胀果甘草[28, 29]和乌拉尔甘草内生真菌[30, 31]的报道, 他们采用可培养方法从这两类甘草中分离出的内生真菌优势菌群主要是梭孢霉菌属(Fusidium)和镰孢属(Fusarium)。本研究首次运用DGGE免培养方法对光果甘草和胀果甘草内生真菌种群多样性进行分析, 测序结果表明, 光果甘草中共有10个真菌属, 胀果甘草中共有11个真菌属, 其中链格孢属为这两类甘草的优势菌属, 这与前人的研究结果存在差异, 主要原因可能与分析手段和试验材料不同有关。链格孢属是引起植物病害的重要真菌类群之一, 豆链格孢(Alternaria azukiae)是甘草叶斑病的致病菌[32]。尽管本研究结果表明链格孢属是光果甘草和胀果甘草的优势菌群, 但本研究采集的甘草样品均为无明显感病症状的健康植株, 导致这一结果的原因可能是, 病原真菌在与宿主植物长期共存的相互作用以及自身演变的过程中[33], 由于环境的改变导致其致病能力丧失, 进而演化成为宿主体内的正常菌群[34]。此外, 已有研究表明, 链格孢属内生真菌能产生具有生物活性化合物的能力[35, 36], 这些活性物质不仅具有抗病原真菌的作用[37], 还具有抗恶性细胞增生的作用[38], 为进一步筛选具有生产活性天然产物功能的内生真菌提供了丰富的资源。
本研究还发现, 枝孢属(Cladosporium)只在胀果甘草根组织中存在, 而在胀果甘草的其它组织及光果甘草中都没有检测到, 其原因可能是DGGE技术有局限性[39], 或是植物种类不同, 基因水平和遗传背景的差异导致其内部环境的差异, 而导致内生真菌的类群有所不同。但是, 除了枝孢属以外的其它10种菌属在光果甘草和胀果甘草中均有分布, 其原因可能是内生真菌在植物科的水平上具有一定的偏好性[40], 而且这两种甘草在相同环境和地域的影响下, 群落的多样性演替过程相似, 导致内生真菌多样性及群落结构相似。
内生菌在植株体内的分布通常为下部组织多于上部组织, 越往植株顶部, 内生菌越少[41]; 从甘草各组织中分离内生真菌根部最多, 茎部次之, 叶部最少[30]; 对于药用植物而言, 枝条同叶片相比内生真菌的种类更为丰富[13]。本研究通过DGGE图谱分析发现, 光果甘草的茎组织中内生真菌的多样性最丰富, 而胀果甘草根组织内生真菌多样性最丰富, 表明甘草根、茎组织内生真菌丰富度明显高于其它组织, 其原因可能是植物体根围区域是一个能量和物质交换异常活跃的区域, 根系内生真菌的侵染程度较地上部分要强, 而叶片内生真菌多以局部侵染为主[42], 从而导致根组织内生真菌多于地上组织的。此外, 内生真菌还可以很容易地穿过植物皮层进入木质部导管中, 使茎组织内有较丰富的内生真菌种群[43]。
研究新疆塔里木盆地光果甘草和胀果甘草内生真菌多样性及其群落结构, 可以帮助了解不同种类甘草的遗传多样性和系统发育情况。甘草作为新疆塔里木盆地一种常见的药用植物, 其内部的真菌存在明显的多样性, 可作为一种较理想的分离内生真菌的植物资源, 为真菌资源的筛选提供理论依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|