第一作者:余红兵(1976-),女,湖南益阳人,副教授,博士,主要从事园林植物及沟渠湿地植物净化研究。E-mail:bingbingyu76@163.com
本研究以绿狐尾藻( Myriophyllum elatinoides)湿地系统为对象,分析绿狐尾藻湿地系统中NH4+-N的去除规律及氮质量平衡。结果表明,试验第28天,在200和400 mg·L-1 N H4+-N两个处理中,水体全氮(TN)去除率分别为86.1%和77.7%,N H4+-N去除率分别为89.8%和78.8%。根据氮质量平衡得出,在200和400 mg·L-1 N H4+-N两个处理中分别有14.7%和30.2%的外源N H4+-N直接被底泥吸附,25.3%和11.0%转化成底泥NO3--N,29.7%和12.7%被绿狐尾藻直接吸收利用,14.0%和23.3%残留在水体,剩余16.3%和22.8%可能被微生物硝化反硝化作用去除。研究结果表明,绿狐尾藻对氨氮有较好的净化效果,为其在人工湿地的应用提供了科学依据。
In the present study, the ammonium nitrogen removal characteristics and nitrogen mass balance in indoor Myriophyllum elatinoides wetland system were analysis. The results showed after 28 days treatment with 200 and 400 mg·L-1 NH4+-N, the removal rates of total nitrogen (TN) and N H4+-N in artificial wastewater were 77.7% and 86.1% , 89.8% and 78.8%, respectively. According to the nitrogen mass balance, 14.7% and 30.2% of the exogenous N H4+-N were transformed into sediment N H4+-N and 25.3% and 11% of exogenous N H4+-N were transformed into sediment NO3-N by 200 mg·L-1 N H4+-N and 400 mg·L-1 N H4+-N treatments; 29.7% and 12.7% of exogenous N H4+-N was absorbed by M. elatinoides; 14.0% and 23.3% of exogenous N H4+-N became residual nitrogen in the water and 16.3% and 22.8% of exogenous N H4+-N eventually to nitrification and denitrification removal. The results suggested that M. elatinoides can effectively purify ammonium nitrogen which provides scientific basis for its application in artificial wetland.
近年来, 随着工业发展和养殖业的集约化, 高氨氮废水排放造成了严重的环境问题[1]。氮引起的地表水、地下水污染, 已对农业、渔业等多个行业造成危害, 已威胁到人们的健康安全[2]。常用的氨氮废水处理方法有厌氧/好氧工艺(A/O)、活性污泥法(SBR)、膜生物反应器(MBR)、氧化沟、人工湿地等[3, 4]。活性污泥法和膜生物反应器等处理工艺程序复杂, 技术成本较高。与其它处理工艺相比, 人工湿地是一种简单有效、价格低廉的处理技术, 已广泛用于处理农业、工业、矿山废水和生活污水[5, 6, 7]。
人工湿地由植物-基质-微生物组成, 在其内部发生着许多物理、化学和生物过程。在人工湿地中, 氨氮去除的主要途径有植物吸收、基质吸附、氨挥发和微生物硝化反硝化等[8, 9]。水生植物对于人工湿地的氮去除起着重要作用。除植物本身对氮素直接吸收外, 水生植物的存在还可改变基质的理化特性、提高系统中溶解氧含量[10, 11], 同时, 水生植物还可作为先锋植物用于相应重金属污染严重区域[12, 13]。然而, 水体中氨氮浓度过高, 会对水生植物产生一定的毒害作用, 并抑制其正常生长[14]。由于许多植物不能耐受高氨氮, 因此, 人工湿地在处理高氨氮废水的应用中受到限制。绿狐尾藻(Myriophyllum elatinoides)为小二仙草科(Haloragidaceae)狐尾藻属, 系多年生沉水或浮水草本植物, 其不仅营养价值高, 是优质饲料和绿肥, 而且对水体氮、磷也有较强的吸收能力。研究表明, 绿狐尾藻对高氨氮具有较强的耐受性, 可作为生态治理的先锋植物[15]; 同时相对于大薸(Pistia stratiotes)、凤眼莲(Eichhornia crassipes)等水生植物, 具有较小的生态风险[16]。且处理废水的绿狐尾藻净化系统中微生物对沉积物的脱氮发挥重要作用[17, 18], 但有关绿狐尾藻湿地对高氨氮废水的去除效率及其主要去除途径的报道不多。本研究以绿狐尾藻湿地系统为对象, 分析绿狐尾藻湿地系统对不同负荷氨氮的去除特征, 研究外源氨氮在该系统的质量平衡, 旨为推广绿狐藻湿地在废水处理中应用提供科学依据。
供试植物绿狐尾藻采自长沙县金井镇野外生态沟渠。试验前, 选取长势较一致的植株, 剪取顶端20 cm, 在清水中预培养1周。供试水为人工配置的高氨氮营养液, 其氨氮由纯度为99.5%的硫酸铵提供。湿地基质为混合均匀的风干过筛水稻土, 其土壤总氮(TN) 含量为1.86 g· kg-1, 总磷(TP)含量0.83 g· kg-1, 有机碳含量21.93 g· kg-1, pH为6.3, 沙土、粉土、粘土含量分别为32.6%、41.1%、26.3%。
该试验在玻璃温室内进行, 试验时间为2013年8月14日至9月11日。试验期间, 温室内的气温为18.8~37.4 ° C。选用透光钢化玻璃箱(长50 cm× 宽40 cm× 高50 cm)作为小型人工湿地装置, 构建表面流人工湿地。每个装置加入20 kg基质土, 土层为10 cm。将选取的绿狐尾藻植株移入湿地装置, 植物密度为500株· m-2。为了使植物适应湿地环境, 先在清水中预培养1周。将清水完全排出后, 加入15 L高氨氮水, 水深为5 cm。试验共设置3个污染负荷的处理, 即含N
1.3.1 水样采集 水样采集时间是0、1、4、7、10、14、17、21、25 和28 d。水样过0.45 μ m孔径滤膜后, 直接用流动分析仪(Fir-5000)测定铵态氮(N
1.3.2 底泥样品采集 在0、1、7、14、21、28 d用圆柱形采样器采集底泥样, 将根系、石子等杂质去除, 然后混均分装, 放入-20 ℃冰箱保存待测。其中, 鲜样用2 mol· L-1 KCl溶液浸提后, 用流动分析仪(Fir-5000)测定底泥N
1.3.3 植物样品采集 在1、4、7、10、14、17、21、25、28 d, 用直尺分别量取各处理植株的株长。在试验的0和28 d, 采集绿狐尾藻植株样品。样品带回实验室后, 用蒸馏水清洗, 待晾干后, 经105 ℃杀青30 min后, 放置70 ℃烘箱烘干至恒重, 并计算其生物量。将烘干植物样磨碎, 过0.250 mm孔径筛, 装入自封袋中保存。植物样品中的TN经浓硫酸-过氧化氢消解后, 用流动分析仪(Fir-5000)测定其氮浓度。
氮质量平衡法可用于评估湿地系统中的氮去除途径及其贡献率[20]。在人工湿地系统中, 植物吸收、底泥吸附、氨挥发和微生物硝化反硝化是铵态氮去除的主要途径。植物吸收氮量由鲜重乘以单位鲜重的植物全氮含量得出, 底泥吸附氮量由鲜重乘以底泥含氮量得出, 水体氮量由水样总氮浓度乘以水体积得出。基于以上内容, 由微生物硝化反硝化作用去除的氮量可由以下公式推算得出:
N=I-F-P-F-S-V.
式中:N为微生物硝化反硝化去除的氮量; I为废水中的初始氮量(g); F为试验结束时废水中残留的氮量(g); P为植物吸收的氮量(g); S为底泥中累积的氮量(g); V为氨挥发的氮量(g), 由于试验期间废水中pH在5.59~7.43, 远低于氨挥发所需的pH 8.0[21], 因此, 本研究中氨挥发损失的氮量可忽略不计。
各部分氮质量计算方法:进水总氮量和水体残留总氮量直接用培养液体积与试验前后浓度相乘得出; 由于添加自配溶液不含有机氮, 所以近似认为底泥吸附氮增量等于铵态氮、硝态氮增量的和; 绿狐尾藻吸收量为植物鲜重增量乘以干鲜比再乘以植物全氮含量得出。
I=Vw× Cw;
F=Vw× Cf;
P=M1× Cp;
S=M2× Cs.
式中:Vw为水体积(L); Cw为试验开始时的水体总氮浓度(mg· L-1); Cf为试验结束时的水体总氮浓度(mg· L-1); M1为植物收获鲜重(g); Cp为植物全氮含量(mg· kg-1); M2为植物收获鲜重(g); Cs为底泥全氮含量(mg· kg-1)。
28 d后200、400 mg· L-1 N
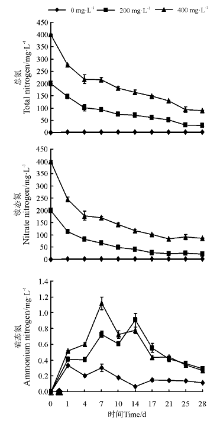 | 图1 水体总氮、铵态氮、硝态氮浓度的变化Fig.1 Changes in the concentrations of ammonium nitrogen total nitrogen and nitrate nitrogen in water |
0-28 d内, 200和400 mg· L-1处理的水体N
200和400 mg· L-1处理, 底泥N
 | 图2 底泥铵态氮和硝态氮浓度的变化Fig.2 Changes in the concentrations of ammonium nitrogen and nitrate nitrogen in sediments |
200 mg· L-1处理中N
经过28 d的培养, 绿狐尾藻全氮含量及植株株长明显增加。试验前后, 0、200、400 mg· L-1处理植物的鲜重分别为211.3、397.3和345.0 g。200 mg· L-1处理的全氮含量及植株株长增加量最大, 增加量分别为22.3 mg· kg-1和44.3 cm, 400 mg· L-1处理次之, 空白对照最低, 其中绿狐尾藻在400 mg· L-1处理培养下28 d生物量低于200 mg· L-1处理, 全氮含量少3.5 mg· kg-1, 植株株长少7.7 cm(图3)。可见, 一定铵态氮浓度有利于绿狐尾藻的生长, 但铵态氮含量过高, 反而会影响植物生长。
28 d后, 200和400 mg· L-1处理中, 14.0%和22.3%的外源N
| 表1 试验系统在试验28 d后的氮质量平衡 Table 1 The total amount of nitrogen of all parts of the system after 28 days test |
28 d的试验过程中, 0 mg· L-1处理的绿狐尾藻生长利用的氮全部来自底泥N
在只添加外源N
高浓度N
室内绿狐尾藻湿地系统对高N
不同浓度N
绿狐尾藻湿地对于高浓度N
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|



