第一作者:林志魁(1990-),男,福建东山人,在读硕士生,主要从事植物遗传转化研究。E-mail:371093941@qq.com
为了诱导愈伤组织,本研究以绿洲3号( Arundo)为试验材料,分别以NaClO(商品名为安替福民)和HgCl2(升汞)对其茎段进行消毒,然后取无菌茎段及从无菌茎段长出来的幼芽和幼叶为外植体,利用不同浓度的激素及1.0 g·L-1聚乙烯吡咯烷酮对外植体进行愈伤组织诱导。结果表明,以0.1% HgCl2溶液消毒18 min的消毒效果最佳,污染率为13%;而NaClO不能有效地消毒,且对茎段有一定的毒害作用。以MS+0.5 mg·L-1 6-BA+1.0 g·L-1 PVP+3.0 mg·L-1 2,4-D培养基配方的诱导效果最佳,且3种外植体中愈伤组织最难诱导的为幼叶,其次是茎段,最易诱导的为幼芽。其中,1.0 g·L-1 PVP能显著促进芽诱导率,使得出愈率达到100%。
In order to induce callus, the experiment was conducted to study the sterilization effects of NaClO (or Antiformin) and HgCl2 on stems respectively by using Lvzhou No.3 as materials. We took the sterile stems, germs and young leaves derived from the sterile stems as explants, different concentrations of hormones and 1.0 g·L-1 PVP were used for callus induction. The results showed that the best sterilization effect is to use 0.1% HgCl2 to sterilize for 18 min and the pollution rate was 13%. While NaClO cannot be sterilized effectively, and it also has toxic effect on stem segment. The culture mediums with best induction effect were MS+0.5 g·L-1 6-BA, 1.0 g·L-1 PVP and 3.0 g·L-1 2,4-D. In three kinds of explants, the order of induction rate was germs>stems>young leaves. 1.0 g·L-1 PVP can be used to promote the induction rate of buds significantly, making 100% callus formation.
绿洲3号(Arundo)原取于福建省福州市永泰县, 是一种单子叶禾本科芦竹属植物, 未确定其种, 植株高大直立, 根系发达, 为多年生丛生草本植物。由国家菌草工程技术研究中心引进该草, 可作为栽培灵芝、猴头菇和杏鲍菇等多种食用菌的优质培养料, 而目前较多应用在园林绿化以及制备生物质材料和植物纤维板材料, 且是防风治沙的优良草种。2013年5月17日将其与巨菌草相结合用于内蒙古阿拉善防沙固沙, 成效显著。其茎杆直立、挺拔、中空, 株高通常为7 m, 茎粗约3 cm, 叶长68.0~73.5 cm, 叶宽6.6~8.0 cm, 可分枝, 每个节均能长芽。芦竹被称为低洼盐碱地的“ 先锋植物” , 因其耐寒、耐旱、耐盐碱, 且在贫瘠的土壤里具有一定的忍耐力[1, 2], 可以在盐沼、沙地、后备土地及废弃矿场进行种植, 从而一定程度上缓解我国耕地面积紧张的状况。芦竹主要分布于我国的12个省(区), 北起辽宁、安徽, 南至福建、台湾、广西等, 已经形成了一定规模的生产地区, 主要分布于江苏省及沿海等地区。芦竹用途广泛, 根茎是很好的中药材, 具有止呕生津、清热泻火的功效[3]; 枝叶细嫩多汁, 是牲畜的良好青贮饲料[4]; 茎秆是优质造纸原料[5]和良好的管乐簧片材料, 并可编织用具和制造人造丝[4]。此外, 芦竹对Ni、Cd、Hg和Pb等重金属有良好的吸附作用, 可用于改善和修复土壤的重金属污染[6, 7]。国内关于芦竹的研究较多的集中在湿地中的生理和生态特征及对重金属的富集和耐性等方面[7, 8, 9, 10]。除已见报道的关于芦竹腋芽萌发、增殖及生根培养基的筛选和优化[11]外, 近年来, 对于芦竹快繁体系建立的报道并不多见。在2015年, 中国保护黄河基金会已批准设立“ 菌草工程技术保护黄河流域专项基金” 。由于绿洲3号在抗寒性、防止水土流失和荒漠化上成效显著, 所以未来5年将在黄河沿岸大面积种植绿洲3号, 在这之前急需解决绿洲3号的快繁体系和相关技术问题。本研究对绿洲3号的愈伤组织诱导进行初步探索, 以期为绿洲3号组织培养体系和遗传转化体系的建立奠定基础, 同时为绿洲3号的推广应用提供技术支持。
绿洲3号是芦竹属植物, 未确定其种, 由国家菌草工程技术研究中心提供, 是试验中的新材料, 取其分枝的枝条为外植体。
1.2.1 获得无菌外植体
无菌茎段的制备:以单节绿洲3号的茎段为外植体, 将茎段去掉叶片剪成2~3 cm长的小段, 每个茎段保留一个节。剪取新鲜植物材料后, 放入洗衣粉中漂洗30 min, 用流水冲洗1 h, 在超净工作台上用无菌水冲洗3次, 用75%的乙醇浸泡30 s, 以不同浓度的 HgCl2(升汞)和NaClO(商品名安替福民)分别浸泡不同的时间, 再用无菌水冲洗3遍。其中, HgCl2浓度分别为0.1%、0.5%和1.0%, 浸泡时间为6、12、18 min; NaClO浓度分别为10%、30%和60%, 浸泡时间为10、20、30 min。放入无菌滤纸上吸干表面的水分[12]。将经过消毒剪切的茎段放入MS培养基上, 各设9个处理, 每个处理8瓶, 每瓶接种4个, 3次重复。 25 ℃光照条件下培养, 7 d后统计污染率和发芽率, 比较消毒效果。
无菌芽制备:以绿洲3号无菌茎段长出的芽为外植体, 将无菌芽切成0.5~0.8 cm, 放入诱导培养基上, 设8个处理, 每个处理8瓶, 每瓶接种4个, 3次重复。在25 ℃条件下暗培养, 30 d后观察统计愈伤组织的诱导率。
无菌幼叶制备:以绿洲3号无菌茎段长出的幼叶为外植体, 取无菌苗的幼叶切成大小0.5~1.0 cm放入诱导培养基上, 设8个处理, 每个处理8瓶, 每瓶接种4个, 3次重复。在25 ℃条件下暗培养, 30 d后观察统计愈伤组织的诱导率。
1.2.2 愈伤组织的诱导 将外植体接种到MS基本培养基上, 并附加不同浓度的6-BA和2, 4-D组合。将外植体材料接种含2, 4-D浓度分别为0.5、2、3 mg· L-1的MS+0.5 mg· L-1 6-BA+1.0 g· L-1 PVP培养基中, 在25 ℃黑暗条件下培养。每个处理接种32瓶, 3次重复, 接种30 d后统计愈伤组织诱导率。
污染率=(污染外植体数/接种外植体数)× 100%;
发芽率=(发芽外植体数/接种外植体数)× 100%;
愈伤组织诱导率=产生愈伤组织的外植体/接种的外植体总数× 100%。
取以上各处理3次重复的平均值为结果数据, 运用统计分析软件SPSS 20.0进行数据的显著性检验和分析。
2.1.1 HgCl2对绿洲3号茎段的消毒效果 利用不同浓度的HgCl2对外植体进行不同时间的消毒试验, 结果表明(表1), A1处理的污染率最高, 达到了19%, A2和A3差异不显著(P> 0.05), 而从A5到A9均未发现污染, 但是发芽率都低于40%, 特别是A8和A9的发芽率仅约为6%。发芽率除A2、A3之间, A9、A8之间差异不显著外, 其它各处理间差异显著(P< 0.05)。随着HgCl2处理浓度的升高与消毒时间的延长, 污染率下降, 除A1、A2和A3外发芽率也呈下降趋势。但是, 使用0.1% HgCl2为消毒剂时, 随时间的延长, 污染率下降, 而发芽率却逐渐上升, 与其它处理浓度所表现出的结果相反, 具体影响机制有待进一步的研究。本试验结果表明, 利用升汞对绿洲3号茎段进行消毒的最佳条件为0.1%升汞消毒18 min。
| 表1 不同浓度的HgCl2对绿洲3号茎段的消毒效果 Table 1 The disinfection effect of different HgCl2 concentrations on stems of Lvzhou No.3 |
2.1.2 NaClO对绿洲3号茎段的消毒效果 NaClO消毒外植体的发芽率在0~23%, 且消毒10、20 min外植体的污染率在84%~99%, 消毒30 min外植体污染率在45%~60%(表2)。B6、B7、B8和B9处理的发芽率为0。从B1到B5处理中B3处理的污染率显著低于另外4个处理(P< 0.05), 因此, 10%NaClO消毒30 min的处理效果最佳。
| 表2 不同浓度的NaClO对绿洲3号茎段的消毒效果 Table 2 The disinfection effect of different NaClO concentrations on stems of Lvzhou No.3 |
2.2.1 6-BA和2, 4-D对绿洲3号幼叶愈伤组织诱导的影响 分别以MS+0.5 mg· L-1 6-BA和MS+2.0 mg· L-1 6-BA作为基本培养基, 添加不同浓度的2, 4-D, 共8个处理, 在以绿洲3号幼叶为外植体中, 随着2, 4-D浓度的增加, 经1个月培养均未产生愈伤组织。加入不同浓度2, 4-D后, 绿洲3号幼叶出愈率仍为0。
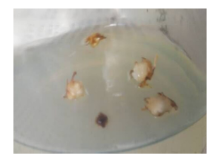
2.2.2 2, 4-D对绿洲3号茎段愈伤组织诱导的影响 试验两周后在部分茎段上长出芽(图1), 部分长出愈伤组织(图2)。以MS+0.5 mg· L-16-BA为基本培养基时, 2, 4-D从0.5~3.0 mg· L-1 , 4个浓度梯度间发芽率没有显著差异(P> 0.05), 为49.660%~54.440%(表3)。出愈率随着2, 4-D浓度的增高呈先上升后下降再上升的趋势。而以MS+2.0 mg· L-16-BA为基本培养基时, 发芽率随着2, 4-D浓度的增高呈下降趋势, 处理D5和D6的发芽率较高, 分别为77.300%和76.910%, 显著高于其它处理(P< 0.05)。出愈率随着2, 4-D浓度的增高呈先升后降再上升的趋势。综合比较, 出愈率在以MS+0.5 mg· L-1 6-BA+3.0 mg· L-1 2, 4-D时达到最高水平, 此时出愈率为38.899%, 显著高于其它浓度(P< 0.05)。
| 表3 不同浓度的6-BA和2, 4-D组合对绿洲3号茎段愈伤组织诱导的影响 Table 3 Influence of different concentrations combination of 6-BA and 2, 4-D on stems of Lvzhou No.3. callus induction |
2.2.3 2, 4-D对绿洲3号芽愈伤组织诱导的影响 以芽为外植体进行诱导时愈伤组织见图3, 出愈率都随着2, 4-D浓度的升高呈现出先减少后增大的趋势, 6-BA浓度为0.5和2.0 mg· L-1时, 出愈率均在2, 4-D浓度为2.0 mg· L-1时达到最低水平, 为0, 显著低于其它处理(P< 0.05)。出愈率在MS+0.5 mg· L-16-BA+3.0 mg· L-1 2, 4-D时达到最高水平, 此时出愈率为86.111%(表4)。
| 表4 不同浓度的6-BA和2, 4-D组合对绿洲3号芽愈伤组织诱导的影响 Table 4 Influence of different concentrations combination of 6-BA and 2, 4-D on bud of Lvzhou No.3. callus induction |
2.2.4 PVP对绿洲3号芽愈伤组织诱导的影响 从出愈率来看, 以MS+0.5 mg· L-1 6-BA+1.0 g· L-1 PVP作为基本培养基, 不同浓度处理中的2, 4-D对绿洲3号幼叶、茎段和芽的愈伤组织诱导出愈率各不相同(表5)。不同浓度2, 4-D对幼叶的诱导, 出愈率均为0, 对茎段的诱导出愈率分别为12.222%、12.778%和35.000%, 而对芽的诱导出愈率差异均达极显著(P< 0.01), 为75.000%~100%。综合出愈率, 以MS+0.5 mg· L-1 6-BA+1.0 g· L-1 PVP其中, 诱导出愈率表现为芽> 茎段> 幼叶。
| 表5 PVP和不同浓度的生长素对绿洲3号愈伤组织诱导的影响 Table 5 Influence of different concentrations combination of auxin and PVP on Lvzhou No.3 callus induction |
植物愈伤组织培养中, 外植体污染是阻碍其成功的最常见问题之一[13]。用自来水较长时间冲洗外植体, 是获得有效消毒的重要环节之一[14, 15], 由于酒精溶液穿透力很强, 消毒时间不宜过长[16], 所以研究中75%酒精消毒时间为30 s。当消毒剂超过一定浓度或消毒时间超过一定范围时会对植物的各种组织造成损伤甚至致死, 且导致外植体污染率下降和死亡率上升[17]。本研究中HgCl2的消毒效果优于NaClO。用不同浓度的NaClO溶液对绿洲3号茎段进行不同时间消毒, 其发芽率最优的仅为25%, 且研究中细菌和霉菌污染严重。而对于同一种外植体茎段, 用HgCl2进行消毒发芽率最佳可达到66%左右。可见, NaClO对绿洲3号外植体的消毒不够彻底, 消毒效果不理想。绿洲3号外植体消毒宜选用0.1% HgCl2溶液。这与其它植物的外植体消毒溶液的选择基本一致, 分别使用多种消毒剂进行消毒时发现, HgCl2溶液消毒效果较好[18, 19, 20]。
愈伤组织诱导中细胞分裂素和生长素是必不可少的[21], 且低浓度的细胞分裂素与中、低浓度的生长素能更好地诱导愈伤组织[22, 23]。这与本研究结果基本一致, 细胞分裂素6-BA浓度为0.5 mg· L-1的诱导率明显高于2.0 mg· L-1的诱导率。在众多禾本科植物组织培养试验中, 2, 4-D被公认为诱导愈伤组织效果最好[24, 25, 26, 27, 28]。2, 4-D浓度在0.5~3.0 mg· L-1的范围内茎段和幼芽都可以诱导出愈伤组织, 但出愈率差异明显, 并且幼叶无愈伤组织。本研究表明, 3.0 mg· L-1是最佳浓度, 这与前人对禾本科的组织培养研究的最佳浓度基本一致[29, 30, 31]。
愈伤组织诱导时1.0 g· L-1 PVP能有效促进绿洲3号芽愈伤组织的诱导, 而对茎段和幼叶的作用不显著。在使用某一浓度范围内的PVP对愈伤组织诱导率有一定的促进作用, 这与肖莉杰等[32]证实1.0 g· L-1 PVP能促进玉米(Zea mays)成熟胚愈伤组织的诱导基本一致。
综上, 绿洲3号茎段消毒中, NaClO对绿洲3号茎段有一定的毒害作用, 消毒后使茎段发黄和软化而致死。为尽量降低污染率, 又保持较高发芽率, 用0.1% HgCl2溶液消毒18 min效果最佳。绿洲3号愈伤组织诱导中, 以芽、幼叶和茎段为外植体, 最佳诱导愈伤组织培养基为MS+0.5 mg· L-1 6-BA+1.0 g· L-1 PVP+3.0 mg· L-1 2, 4-D, 其中以芽的出愈率最高为100%。在绿洲3号芽诱导中加入1.0 g· L-1 PVP能显著促进诱导率。
综上, 绿洲3号茎段消毒中, NaClO对绿洲3号茎段有一定的毒害作用, 消毒后使茎段发黄和软化而致死。为尽量降低污染率, 又保持较高发芽率, 用0.1% HgCl2溶液消毒18 min效果最佳。绿洲3号愈伤组织诱导中, 以芽、幼叶和茎段为外植体, 最佳诱导愈伤组织培养基为MS+0.5 mg· L-1 6-BA+1.0 g· L-1 PVP+3.0 mg· L-1 2, 4-D, 其中以芽的出愈率最高为100%。在绿洲3号芽诱导中加入1.0 g· L-1 PVP能显著促进诱导率。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|