第一作者:张玉云(1988-),女,湖北丹江口人,在读硕士生,主要从事生物多样性与生态保护研究。E-mail:504710220@qq.com
采煤活动所致的动态沉陷湿地具有动态性、高潜水位和生态脆弱性等特点,探明此类人工重构湿地的水生植物群落的生物学特性及其竞争机制,有助于为采煤沉陷区湿地水生植物群落修复提供科学依据。本研究以淮南潘集区人工构建的苦草群落(Ass. Vallisneria natans)为例,采用样方调查法,研究苦草的生物学特性及其与其他水生植物的竞争机制。结果表明,1)沉陷区苦草的生物学特性与浅水湖泊较一致。主要表现在苦草的繁殖方式、传粉方式、生活史方面,但研究区苦草以有性繁殖为主。2)沉陷区苦草能与以种子萌发形成的水烛群丛(Ass. Typha angustifolia)共生,但生物量低;在与形成两年以上的水烛群丛竞争中处于劣势,在水烛群丛盖度达到90%时苦草逐渐消失。3)沉陷区苦草在与浮叶植物莕菜群丛(Ass. Nymphoides peltatum)、苹群丛(Ass. Marsilea quadrifolia)竞争中处于弱势,其盖度、株高、生物量等指标都明显下降。4)沉陷区苦草在与沉水植物竹叶眼子菜群丛(Ass. Potamogeton malaianus)竞争中处于劣势,苦草与沉水植物黑藻群丛(Ass. Hydrilla verticillata)、狐尾藻群丛(Ass. Myriophyllum verticillatum)、大茨藻群丛(Ass. Najas marina)、金鱼藻群丛(Ass. Ceratophyllum demersum)占据不同水层空间,种间竞争不强烈,能较好地共存。总之,苦草较之于相似生长型的植物具有较明显的竞争优势,对于具有不同生活型,尤其是挺水植物和浮叶植物,处于竞争劣势。
The mining subsidence wetland has obvious characteristics of dynamic, high ground-water level and ecological frangibility. Exploring the biological characteristics and competition mechanism of artificially constructed aquatic plant community is beneficial to recover aquatic vegetation in mining subsidence wetland. This study takes the dominant species of Vallisneria natans as an example to analyze its biological traits and competition mechanisms in Panji District of Huainai City by means of field survey and sampling quadrat investigation. The results showed that V. natans in subsidence area have same biological characteristics (reproductive pattern, pollination mechanism and life history) as plants in shallow lakes, but sexual reproduction was the dominant reproduction way for V. natans in study area. V. natans could grow with current-year Ass. Typha angustifolia community with low biomass; however, V. natans has a competitive disadvantage with two or more years Ass. T. angustifolia community and V. natans would gradually disappeared when coverage of T. angustifolia was ≥90%. V. natans had poor competitiveness with floating plant Ass. Nymphoides peltatum and Ass. Marsilea quadrifolia in mining subsidence area with coverage, plant height and biomass decreasing. V. natans also had poor competitiveness with submerged plants Ass. Potamogeton malaianus while could coexist well with Ass. Hydrilla verticillata, Ass. Myriophyllum verticillatum, Ass. Najas marina, and Ass. Ceratophyllum demersum by inhabiting different water layers. In conclusion, V. natans have obvious competition advantages at the aquatic plant community in identical water layer with similar growth form, while poorly compete to plants with different growth form, especially emerged plants and floating plants.
苦草(Vallisneria natans), 水鳖科(Hydrocharitaceae)苦草属(Vallisneria), 多年生沉水植物, 是我国淡水湖泊中最常见的典型沉水植物之一。苦草广泛分布于淡水环境中, 在1~3 m的水深中均有分布。苦草在静水水体中普遍存在, 由于其根系强大, 叶片带状、柔软, 在溪流生境中也能生存。苦草生态适应性广, 对氮、磷等营养元素具有较强的吸收能力[1, 2, 3, 4], 是减少水体污染, 缓解水体富营养化程度的重要沉水植物[5]。苦草具有有性和无性两种生殖方式, 繁殖速度快, 再生能力强, 刈割后恢复的时间短, 常被作为沉水植物恢复主要工具物种。近年来, 有关苦草的生物学特性的研究主要集中在植物生活史策略、繁殖对策和种子的萌发特征等方面[6, 7, 8, 9, 10, 11, 12, 13, 14, 15]。
在水生环境中, 具有相似的生长型并且在水层中占据同一位置的植物之间的种间竞争被认为是决定群落内物种组成和分布的重要影响因素[16]。近年来, 关于水生植物的竞争关系的研究主要集中在具有相同的生长型或相似形态的物种之间[17, 18, 19, 20, 21, 22], 混合栽培时的生物量比单独栽培时大大减少。不同生长型的植物群落间的竞争机制的研究也日益增多[22, 23, 24]。生长高大, 能在水面形成匍匐层的水生植物, 在营养较丰富和生产力较高的水面占据优势, 个体矮小, 具有类似莲座状生长型特征的植物, 主要分布在贫营养型群落中。
两淮煤矿沉陷区湿地重构技术研究及其生态服务功能示范是解决非稳沉陷区浅水湿地高效利用的有效途径。在两淮高潜水位地区, 煤层开采导致地表沉陷形成3种类型的湿地:轻度沉陷湿地(水深≤ 1 m), 中度沉陷湿地(水深1~2 m), 深度沉陷湿地(水深> 2 m)。近年来, 植物间的竞争作用研究多集中于那些具有相似生长型, 在水体中占据同一空间位置的植物间, 但对于生长型完全不同或形态学上具有显著差异的物种之间竞争的研究却开展较少。研究沉陷区苦草的生物学特性及其与其他水生植物的竞争机制, 可以揭示其规律, 指导湿地植物群落重构和科学管理, 从而有利于维持重构区的水生植物群落稳定, 为生态渔业提供稳定高效的初级生产者, 保持物种多样性, 充分发挥沉陷湿地的生态服务功能。
试验区位于安徽省淮南市潘集区泥河镇后湖生态园(32° 23'17″-32° 51'49″ N, 116° 21'03″-117° 12'47″ E)。淮南市位于淮河之滨, 是安徽省中北部的重要城市, 是中国最重要的煤矿城市之一。属于暖温带半湿润季风气候, 四季分明、雨热同期、冬夏季长, 年平均气温在15.2~15.3 ℃, 年平均降水量891.6 mm。泥河镇地处淮河北岸冲积平原, 位于淮南市潘集区东偏北20° , 属于典型的高潜水位采煤沉陷区。沉陷区水生植物群落重构前, 平均水深在1 m以内, 主要由农田沉陷形成, 水生植物以稗子(Echinochloa crusgalli)、水烛(Typha angustifolia)和假稻(Leersia japonica)为主, 为典型的农田生态系统。试验于2012年11月开始, 至2014年12月结束。依据安徽省典型浅水湖泊水生植物群落的分布格局, 选取淡水湖泊中的典型优势物种菰(Zizania latifolia)、莕菜(Nymphoides peltatum)、水鳖(Hydrocharis dubia)、苦草、金鱼藻(Ceratophyllum demersum)、狐尾藻(Myriophyllum verticillatum)、竹叶眼子菜(Potamogeton malaianus)、大茨藻(Najas marina)和黑藻(Hydrilla verticillata)作为重构群落的工具物种。通过播撒种子和移栽实生苗的方法, 将所有工具物种栽种到试验区[25], 构建以苦草为优势种的水生植物群落。
从2013年至2014年, 以样方法为主, 结合样线法对研究区的物种进行调查。样方法主要研究, 1)苦草与当年生长的水烛群丛的竞争机制, 具体设置方法为:以研究区水深为2 m的沟渠为起点, 向岸边沿直线连续设置10个1 m× 1 m大小的样方进行调查; 2)试验区苦草与其他水生植物的竞争机制, 具体设置方法为:随机设置样方大小为1 m× 1 m的3个采样点进行样方调查, 用彼得森采泥器(1/16 m2)将样方内的所有植物连根夹起, 洗净淤泥, 除去杂质, 按种分开, 测量并记录样方内各物种的盖度、株高、密度及生物量等指标。其中挺水植物菰和水烛测量地上部分生物量, 其他物种均为全株生物量。为使获得的数据尽量准确, 在捞取植物放置于船上5 min后, 待水沥干, 再称其鲜重。将各个样方内的鲜植株带回实验室放置于105 ℃的烘箱内杀青30 min, 70 ℃烘干至恒重, 测量其干重, 每个样点采集3次, 取平均值计算生物量。调查过程还记录水温、水深、水体透明度等指标。
用Excel 2010软件进行数据处理, 并制图。在制图表前, 对于所得的数据通过log(1+x)转换后进行统计分析。采用SPSS 19.0 软件对所测数据进行统计分析, 影响苦草生物量的相关因素采用Spearman 方法进行相关性分析, 对苦草和水烛的各生长指标进行单因素方差分析, 并用Duncan法对各个测定的数据进行多重比较。
2013年至2014年, 每月两次对后湖试验区水生植被进行调查。调查发现共有典型水生植物26 种, 隶属于17 科24 属, 其中蕨类植物有2 科2 属2 种, 双子叶植物有5 科5属5 种, 单子叶植物10 科16 属19 种。 挺水植物以水烛和菰为优势种, 伴生种为芦苇(Phragmites australis)和假稻, 浮叶植物以莕菜为优势种, 伴生种为水鳖和苹(Marsilea quadrifolia), 沉水植物以苦草为优势种, 伴生种为竹叶眼子菜、金鱼藻、狐尾藻、黄花狸藻(Utricularia aurea)、大茨藻和黑藻。
苦草生物量的变化主要受苦草的生活史影响。野外观测发现, 苦草于3-4月开始萌发, 6-8月进入分蘖生长的旺盛期, 8-9月生长速率最大, 9月生物量达到顶峰, 10月中旬以后分蘖逐渐停止, 果实逐渐成熟, 落入水中, 进入衰老期, 生物量迅速下降。对研究区连续两年调查发现, 2014年苦草的株高、密度、盖度、鲜重等指标较2013年有明显的下降趋势(图1、图2)。
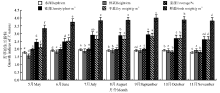 | 图1 2013年不同时期苦草的生长指标变化注:不同小写字母表示相同生长指标不同时期间差异显著(P< 0.05)。图2同。Fig.1 The growth indices of V. natans in 2013Note: Values with different lower case letters for the same growth indices of V. natans show significant differences among different months at 0.05 level. The same in Fig.2. |
通过对研究区优势种苦草的主要生长性状与生物量的相关分析发现, 苦草的生物量与株高具极显著正相关(P=0.000), 生物量与水深、密度呈显著正相关(P=0.013, P=0.048)。苦草的密度与株高呈极显著的正相关(P=0.009), 株高与水深呈显著正相关(P=0.012)(表1)。
| 表1 苦草的生物量与主要生长性状的相关分析 Table 1 Spearman correlation analysis among growth traits of V. natans |
野外调查发现, 苦草具有无性和有性两种繁殖形式。其具有白色的匍匐根状茎, 位于底泥下5~10 cm处, 根状茎的茎节处萌发出不定根, 形成新植株。一株苦草母植株可以连续生长出十几个新植株, 新植株继续向四周生长出匍匐根状茎, 再形成新的子株。在9月份时, 苦草的匍匐茎长度为12.5~21.7 cm, 平均长度可达15 cm, 平均每个植株上已经发育有5~6个新植株。苦草下部的块茎, 只在沟渠处水位保持在2 m以上的区域有发现, 块茎数量较少, 平均每株2~3个。
苦草具有强大的有性繁殖能力。在试验区, 6月下旬至10月下旬是苦草种群的繁殖期。雄花生长于植株的基部, 在佛焰苞中生长成熟后, 雄花脱离总状花序的佛焰苞, 漂浮至水面, 打开花被片, 雄蕊花药开裂, 花粉粒直接粘在花丝顶端, 借助风力或随水流漂动, 传播花粉。雌花单生于螺旋状的花柄上, 随水深伸长的花茎挺出水面, 完成传粉受精。授粉后的雌花闭合, 花柄卷曲, 收缩至水下30 cm左右处, 果实成熟。9月份在试验区调查时发现, 每个植株可发育15~21个花蕾, 可发育成熟果实13~15个, 每个果实的长度为10~19 cm, 果柄长度为58~65 cm。苦草果实数量为1 767个· m-2, 苦草果实鲜重为4 050 g· m-2。
本研究主要分析苦草与研究区的挺水植物水烛、浮叶植物莕菜、苹和沉水植物竹叶眼子菜之间的竞争关系, 主要水生植被类型及生物量变化比较如表2所示。
| 表2 重构区夏季主要水生植被类型及其生物量(2014年8月) Table 2 Types and biomass of mainly aquatic vegetation in reconstruction area(August 2014) |
野外数据监测结果表明, 苦草在与形成两年以上的挺水植物水烛的竞争中处于劣势。苦草单一群丛的株高、盖度、生物量都明显比苦草与水烛共同形成的群丛的要高。水烛能产生大量的种子, 种子萌发以后, 植株具有发达的根状茎组织, 分蘖能力强, 可以通过无性繁殖迅速扩大面积, 在竞争中处于优势。在调查区发现, 水烛的根状茎平均长度为58 cm, 平均直径达2 cm, 平均节间长为8 cm, 每隔7~9节即可发育形成新的植株, 在与苦草共生时具有强大的竞争力。单一苦草群丛最大鲜重达到10 050 g· m-2, 能够开花、结果。在形成两年以上的水烛群丛中, 初期水烛幼苗刚生长时, 苦草种子能够萌发形成幼苗, 苦草群丛的最大鲜重为1 710 g· m-2, 6月份时, 在水烛盖度达到90%的区域, 苦草逐渐在水烛群丛中消退。
在以种子萌发形成的水烛群丛中, 苦草能与水烛共存(图3、图4)。苦草的生物量、盖度在距离沟渠0.5 m处达到最大, 此时水深达1.5 m, 水烛难以存活。水烛的生物量、密度、盖度在距离沟渠7.5 m处达到最大, 而在此处, 距离岸边较近, 水深在30 cm左右, 不适合苦草生长, 苦草的盖度、株高、生物量都明显低于水烛。通过对比发现, 在距离沟渠5~6 m处, 水深保持在45 cm左右时, 苦草与水烛能共存, 但苦草的鲜重相对于单一群丛的苦草则明显下降, 平均湿重只有3 417.36 g· m-2, 多数植株不能开花、结果。越靠近岸边, 水位逐渐变浅, 苦草的株数、盖度、株高、生物量呈明显下降趋势, 水烛的株数、株高、生物量一直保持增加的趋势。
 | 图3 种子萌发形成的水烛群丛中苦草的生长特性注:不同小写字母表示相同生长指标在距离沟渠不同位置间差异显著(P< 0.05)。图4同。Fig.3 The growth characteristic of V. natans in T. angustifolia associations by seed germinationNote: Different lower case letters for the same growth indices of V. natans show significant differences among different distances to the trench at 0.05 level. The same in Fig.4. |
 | 图4 种子萌发形成的水烛群丛中水烛的生长特性Fig. 4 The growth characteristic of T. angustifolia in T. angustifolia associations by seed germination |
苦草在与浮叶植物莕菜的竞争中处于劣势。当苦草生长在莕菜群丛中时, 莕菜会加强对水上部分叶片和分枝的营养投入, 以占据更多的水面空间和阳光, 抑制水下的沉水植物苦草的光合作用。在野外调查发现, 生长在莕菜群丛下的苦草植株矮小, 最大株数仅有30株, 最大鲜重为500 g· m-2。在莕菜与苦草共同生长区, 莕菜的单株叶片数量要比莕菜的单一群丛的莕菜多4~5片, 株高为165~239 cm, 单株可生长9节, 节间长度为17~71 cm。6月份, 莕菜盖度达到60%左右时, 莕菜群丛下面的苦草基本消亡。
苦草在与根生浮叶植物苹的竞争中处于劣势。在苹群丛中, 苦草的最大密度为276株· m-2, 最大鲜重为1 930 g· m-2。苹是蕨类植物门苹科植物, 主要依靠根茎芽和孢子繁殖, 繁殖迅速。在研究区发现, 苹可以在水面形成一层平均厚度达27 cm的匍匐层, 盖度超过98%, 能对水下的沉水植物产生遮阴效应, 抑制苦草生长。6月份调查时发现, 将研究区苹的匍匐层翻起后, 在底层生长有少部分的苦草, 但植株矮小, 颜色偏黄, 严重营养不良, 不能完成开花、结果。
苦草与沉水植物的竞争整体上具有较强的抗干扰能力, 在竞争中处于优势地位。野外研究发现, 苦草与研究区其他沉水植物金鱼藻、黑藻、狐尾藻、大茨藻、黄花狸藻等占据不同的水体空间, 能够较好地共存, 但苦草在与沉水植物竹叶眼子菜的竞争中处于劣势地位。在竹叶眼子菜群丛中生长的苦草最大密度仅有100株· m-2, 最大鲜重仅有1 370 g· m-2。竹叶眼子菜的叶片较宽, 呈现明显的根生浮叶植物的表型特征, 85%的叶片分布在水体表面, 形成冠层匍匐于水面上, 能阻挡一部分的阳光, 同时竹叶眼子菜还具有强大的分蘖能力。在研究区发现竹叶眼子菜的株高112~132 cm, 茎长55 cm左右, 茎节间长7~9 cm, 茎节数7~9节, 每隔一节在叶腋处萌发新芽, 形成新的茎, 具有很强的竞争力。
几乎所有苦草种群都存在有性生殖, 但无性繁殖是其每年种群恢复的主要方式[15]。虽然苦草的果实、种子、种子苗的数量都很大, 但在自然条件下无性生殖方式在苦草生活史中起着更重要的作用[26]。在研究区, 苦草既能产生果实进行有性生殖, 也能在地下生长匍匐根状茎, 进行无性繁殖。本研究发现, 在1m深以内的浅水区没有块茎, 仅仅在水深2.5 m的沟渠生长的苦草能够产生小的块茎。一方面可能是因为研究区水位较浅, 有性生殖更有利; 另一方面也可能是研究区处于亚热带季风气候区, 苦草在这一地区的花、果期相对较晚, 完成花、果期后已进入冬季, 营养体枯萎, 研究区水域干涸, 苦草不能进行正常的营养生长, 因此, 不能产生块茎。苦草在长江中下游地区浅水湖泊为一年生, 以有性生殖为主, 只进行微弱的克隆生长, 不能产生克隆繁殖器官块茎(冬芽)[27], 这与本研究的结论相一致。分布在沟渠处的苦草也会开花结果, 但果柄的长度明显高于浅水区域, 单一植株的果实数量却比浅水区少。这可能是因为在沟渠处水体深度大, 为了完成授粉, 植株需要投入更多的能量, 因此, 选择无性繁殖, 增加对匍匐茎和块茎生长的投入。沈显生和胡颖[28]发现, 苦草在有性生殖和营养繁殖之间进行能量分配和生殖价的选择, 在极其不利的环境下, 有的物种会主动选择耗能少的营养生殖方式, 这与本研究观点相一致。
水烛的繁殖方式主要为种子繁殖和地下根状茎繁殖。水烛一般采取有性繁殖[29], 但种子萌发形成的水烛第2年才能抽穗结籽[30]。水烛的繁殖扩散主要是通过根状茎的横向延伸及腋芽的生长来实现的[31]。在苦草与水烛共生群丛中, 当年以种子萌发形成的水烛群丛只能靠地下根状茎来繁殖, 缺乏强大的有性繁殖, 因此, 在水烛生长初期, 苦草能够与水烛共存, 但苦草的生物量十分低, 不能完成开花结果。营养繁殖器官通常比种子具有更多的资源储备而形成强的启动优势, 能迅速占据空间并快速生长, 形成竞争优势[32, 33]。两年以上形成的水烛群丛不仅具有发达的地下根状茎, 进行克隆繁殖, 还能够抽穗结籽, 进行强大的有性繁殖, 因此, 苦草在与形成两年以上的水烛共存的群丛中处于劣势地位。苦草的盖度、株高、生物量显著下降, 在水烛盖度达90%的区域, 苦草逐渐从水烛群丛中消退。
在整个研究区, 重构的水生植物群落的竞争机制主要表现为挺水植物水烛、菰与浮叶植物和沉水植物竞争时, 具有明显的抗干扰优势, 处于竞争优势地位。浮叶植物的竞争力比挺水植物稍差, 比沉水植物强。沉水植物苦草在与浮叶植物莕菜、苹竞争时, 浮叶植物通常选择增加对水上生物量的投入, 在水面形成匍匐层, 形成遮阴效应, 抑制沉水植物的生长, 在竞争中, 沉水植物处于劣势。McLay[34]通过研究发现, 在水生植物中, 竞争能力一般是挺水植物大于自由漂浮植物, 自由漂浮植物大于沉水植物。本研究也证实了水生植物群落中存在这种不同生活型植物之间的竞争能力的差别, 认为挺水植物> 浮叶植物> 沉水植物。
水位直接或间接地调节着水生植物群落的物种组成、分布和多度[35, 36, 37, 38], 水位变化对水生植物的生长和分布都会造成深刻的影响[39, 40]。野外调查发现, 在研究区水深2 m左右的沟渠处, 水烛群丛不能生长, 苦草依然能够正常生长。袁桂香等[41]发现, 深水处理(60 cm)对挺水植物水烛的生长和繁殖都有显著的抑制作用, 淹水深度大于1 m时挺水植物容易死亡。由于水烛和苹的繁殖能力强, 生物量大, 在群落中的竞争力强, 对其他水生植物威胁较大。为了维持重构区水生植物群落的稳定和物种多样性, 必须加强对试验区的水生植物群落的管理, 定期对水烛和苹进行刈割, 确保苦草的优势种地位。对研究区通过为期两年的观测发现, 当试验区水位维持在1.0~1.5 m的水深时, 会对水烛和苹的生长产生抑制作用, 利于沉水植物的生长。因此, 维持试验区相对稳定的水深能够较好地维护试验区水生植物群落的稳定。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|



