第一作者:秦明森(1989-),男,四川高坪人,在读博士生,主要从事丛枝菌根真菌与植物共生研究。E-mail:qinms08@lzu.edu.cn
应用Meta分析(Meta analysis)方法定量研究了接种丛枝菌根(Arbuscular Mycorrhizae,AM)真菌对车轴草属( Trifolium)植物生物量和营养吸收的影响。通过Web of Science®数据库检索,共收集得到30篇原始文献,提取得到525个独立样本值。结果表明,接种AM真菌能够显著增加车轴草属植物的总生物量、地上生物量和地下生物量,促进其对氮、磷的吸收。不同的AM真菌种类以及车轴草种类均对接种效果有影响,其中珠状巨孢囊霉( Gigaspora margarita)对车轴草属植物的生物量的促进效应最大;埃及车轴草( T. alexandrinum)地上、地下生物量对接种AM真菌的响应最强。胁迫处理能显著降低AM真菌对地上、地下生物量的接种效应。随培养时间延长,AM真菌能够显著增加氮、钾、锌吸收的接种效应。
Meta analysis was performed to quantify the effect of AM fungi inoculation on plant biomass and nutrient uptake of Trifolium plant. In this research, 525 independent observations were extracted from 30 published scientific papers through database search of Web of Science®. The results indicated that total biomass, shoot biomass and root biomass of Trifolium were significantly increased by AM fungi inoculum. Plant uptake of nitrogen and phosphorus was also promoted. Both AM fungi species and Trifolium species showed influence on the effect of inoculation. Gigaspora margarita inoculation showed the largest amount of biomass enhancement in Trifolium, while the shoot and root biomass of T. alexandrinum strongly responded to AM fungi inoculation. The stress treatment significantly reduced the effect size of plant shoot and root biomass. The effect size of plant N, K and Zn uptake was significantly positively correlated with incubation time.
丛枝菌根(Arbuscular Mycorrhizal, AM)真菌是一类能与80%陆地植物形成互惠共生关系的微生物, 能够帮助植物吸收土壤中的氮、磷等元素, 作为交换, 植物向其提供碳元素[1]。由于AM真菌不可离体培养, 大部分研究都利用植物接种一种或者多种AM真菌来研究其生理[2]和生态学[3]功能, 而各研究所涉及到的外界环境、宿主植物、培养时间和条件都很难一致, 导致其研究结果差异较大, 甚至存在完全相反的报道, 如在不同胁迫条件下, AM真菌对玉米(Zea mays)根的生物量可能产生相反的作用[4, 5]; AM真菌影响植物对不同类型重金属, 甚至同种重金属的吸收, 都可能存在相反的结果[6, 7]。因此, 人们对AM真菌的生理生态功能难以得到一致的定论, 寻找新的研究方法, 继而得出普遍性结论对于AM真菌研究就至关重要。
Meta分析(Meta analysis)是将多个不同的研究进行汇总后, 再统计分析, 得到普遍结论的定量研究方法。Ecology杂志于1999年刊发7篇论文系统的介绍了Meta分析在生态学中的应用方法, 特别是Hedges等[8]针对Meta分析中反应变量、效应值的选取、异质性的计算、结合效应值的计算等方面进行了理论性的探讨和评述, 为Meta分析在生态学理论研究的迅速发展提供了保证。Meta分析在国外的AM真菌研究已有广泛的应用[9, 10, 11, 12, 13, 14], 但在国内研究中还鲜有报道。
本研究运用Meta分析方法, 以车轴草属(Trifolium)植物接种AM真菌为处理, 不接种AM真菌为对照, 研究接种AM真菌对车轴草属植物生长的影响, 探讨植物种类、AM真菌种类、胁迫处理、培养时间等因素对接种效应的影响, 对AM真菌的普遍功能阐述具有重要意义。
2014年5月8日19:00通过ISI Web of Knowledge(www.webofknowledge.com)检索平台, 以主题: arbuscular mycorrhiza* & Trifolium OR clover, 文献类型: ARTICAL, 时间跨度:所有年份, 对Web of Science® 数据库进行检索, 共获得764篇文献, 其中有效文献需符合以下条件:(1)采用AM真菌接种车轴草属植物, 且有空白接种处理; (2)具有选定的指标:生物量、地上生物量、地下生物量、植物P吸收量、植物N吸收量、其他元素吸收量; (3)具有明确的处理重复数以及试验标准差或者标准误; (4)重复报道的数据只选用其中一篇。通过筛选, 共获得30篇有效文献。以任何一篇文献中的任一车轴草品种、AM真菌品种、培养时间、胁迫处理等观测值为独立样本[11]。提取文献中车轴草空白接种和AM接种下各个指标的平均值(XC:空白均值, XE:接种均值), 标准差(SDC:空白标准差, SDE:接种标准差)或者标准误(SEC:空白标准误, SEE:接种标准误), 空白处理以及接种处理重复数(NC:空白重复数, NE:接种重复数)。其中表和文章数据直接提取, 图片数据通过GetData Graph Digitizer软件进行提取。同时, 将同株植物接种真菌数大于1的视为混合接种, 培养时间一个月按30 d进行统计。
利用MetaWinv2.1软件(http://metawinsoft.com/)中的随机效应模型对提数据进行Meta分析。按照Hedges等[8]计算效应值(Effect Size, E)的方法, 将反应比(Response Ration, R)的自然对数作为计算的样本效应值, 计算公式为:
效应值方差为:
将lnR值和vlnR值按照Hedges[15]提供的方法计算得到各指标的效应值, 效应值显著性由4 999次再取样进行检验, 95%置信区间由MetaWinv2.1软件所整合的自助法(Bootstrap)获得[16], 按照Chandrasekaran等[17]与Mayerhofer等[18]提供的分组异质性分析方法, 确定各指标组内异质性差异。如95%置信区间不与0值重叠, 认为接种AM真菌引起了该指标的显著变化; 不同指标进行比较时, 若它们的95%置信区间不重叠, 则视其差异显著[17, 19]。
考虑到培养时间对结果的影响, 将培养时间作为协变量, 利用Stata v11软件(http://www.stata.com)中的“ metareg” 程序包, 对培养时间与效应值进行Meta回归(Meta regression)[20]分析, 若P≤ 0.05, 则接种效应与培养时间显著相关。
本研究从30篇文献中共提取得到525个独立样本, 培养环境均为室内培养。其中包含来自5篇文献中的29个总生物量样本; 来自20篇文献中的95个地上生物量样本; 来自16篇文献中的70个地下生物量样本; 来自20篇文献中的182个植物磷(P)吸收样本; 来自7篇文献中的40个植物氮(N)吸收样本; 来自2篇文献中的27个植物钠(Na)吸收样本; 来自3篇文献中的36个植物钾(K)吸收样本; 来自4篇文献中的36个植物锌(Zn)吸收样本。本研究就不同AM真菌种类、车轴草属植物种类、胁迫处理、培养时间进行了相互比较。其中, 用于接种的有根内球囊霉(Glomus intraradices)、摩西球囊霉(G. mosseae)、混合接种、地表球囊霉(G. versiforme)、珠状巨孢囊霉(Gigaspora margarita)、幼套球囊霉(G. etunicatum)以及聚生球囊霉(G. fasciculatum), 所占总样本数的比例依次为36.6%、24.2%、15.0%、14.3%、5.7%、3.0%以及1.1%; 用于接种的车轴草属植物种类有地车轴草(T. subterraneum)、白车轴草(T. repens)、红车轴草(T. pratense)以及埃及车轴草(T. alexandrinum), 所占总样本数的比例依次为49.0%、21.5%、19.3%以及10.3%; 培养条件中, 无胁迫处理占47.6%, 有胁迫处理的占52.4%, 其中认为施肥也为胁迫处理。接种总效应值显著为正(自由度=516; E=0.414 2; 95%置信区间:0.369 6-0.458 7; 图1), 其总异质性检验为极显著(总异质性=794.292 6; P=0.000; 表1), 表明全部样本效应值之间具有极显著差异。
| 表1 不同指标Meta分析结果 Table 1 Meta anaylysis results of different plant characteristics |
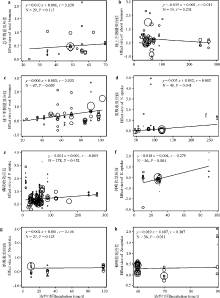
AM真菌接种能够增加植物总生物量、地上生物量和地下生物量(表1、图1), AM真菌对地下生物量的促进效应略高于地上, 但差异不显著(P> 0.05)。通过分组分析发现, 不同的AM真菌种对总生物量、地下生物量的接种效应无显著影响, 而对地上生物量的影响显著(表2、图2a), 其中接种G. margarita对总、地上以及地下生物量的促进作用最强; 不同的车轴草属植物种对总生物量的接种效应无显著影响, 对地上、地下生物量的接种效应有显著影响, 其中T. alexandrinum对地上、地下生物量的促进作用最强(表2、图2b); 有无胁迫对总生物量的接种效应无显著影响, 而对地上、地下生物量的接种效应有显著影响, 其中无胁迫条件下总生物量和地下生物量的接种效应均高于胁迫条件下的效应值, 而地上生物量的变化趋势相反(表2、图2c)。通过Meta回归分析发现, 培养时间与总生物量、地上生物量以及地下生物量的接种效应之间无显著的线性关系(图3a、b、c)。
| 表2 不同指标基于组间异质性和总异质性的显著差异分析结果 Table 2 Significance of factors analyzed in the categorical analyses based on the significance of the variation among categories (QB) and the amount of the total variation (QT) described by QB /QT |
AM真菌接种能够显著地增加车轴草属植物氮的吸收(表1、图1)。不同的AM真菌种、车轴草属植物种、胁迫处理对接种效应的影响均不显著, 但接种AM真菌G. mosseae或以车轴草属植物T. alexandrinum为宿主时植物氮吸收的接种效应值最高; 无胁迫处理下接种效应高于胁迫处理(表2、图4a)。通过Meta回归分析发现, 培养时间与植物氮吸收具有显著的线性关系(图3d)。
 | 图4 接种AM真菌的对植物氮、磷效应值的分析注: a, 植物氮吸收; b, 植物磷吸收。Fig.4 Effects sizes of plant N and P uptake response to AM fungi inoculationNote: a, plant N uptake; b, plant P uptake. |
AM真菌接种能够显著地增加植物磷的吸收(表1、图1)。不同的AM真菌、车轴草属植物、培养时间下, 接种效应之间具有显著差异, 其中接种G. mosseae或以车轴草属植物T. alexandrinum为宿主时植物磷吸收的接种效应值最高; 有无胁迫处理对于植物磷的接种效应无显著影响, 无胁迫处理高于胁迫处理(表2、图4b)。通过Meta回归分析发现, 培养时间与植物磷吸收无显著的线性关系(图3e)。
AM真菌接种降低了植物钾的吸收(表1、图1)。不同的AM真菌种、车轴草属植物种对植物钾吸收的接种效应影响显著, 其中接种AM真菌G. mosseae或以车轴草属植物T. repens为宿主时的接种效应值最高; 胁迫处理对接种效应无显著影响, 无胁迫情况下, 植物钾吸收显著降低(表2、图5a)。通过Meta回归分析发现, 培养时间与植物钾吸收有显著的线性关系(图3f)。
AM真菌接种能够增加植物钠的吸收(表1、图1)。不同的AM真菌种、车轴草属植物种以及胁迫处理的影响均不显著, 其中混合接种AM真菌或以T. repens为宿主植物时的接种效应值最高; 胁迫处理增加了对植物钠吸收的效应值(表2、图5b)。通过Meta回归分析发现, 培养时间与植物钠吸收无显著的线性关系(图3g)。
AM真菌接种能够显著地增加植物锌的吸收(表1、图1)。接种效应值在不同的AM真菌种之间以及有无胁迫处理之间无显著差异; 但在不同的车轴草属植物种之间具有显著差异, 其中以T. repens为宿主植物时效应值最高(表2、图5c)。通过Meta回归分析发现, 培养时间与植物锌吸收具有显著的线性关系(图3h)。
本研究结果与Treseder[9]、Hoeksema等[12]的研究结果相似, 讨论按照对植物总生物量, 地上生物量, 地下生物量, 植物的氮、磷、钠、锌元素吸收的影响顺序进行。
接种AM真菌对总生物量、地上生物量、地下生物量均为正效应, 这与先前大多数研究结果相同[3, 21, 22]。总生物量接种效应最高, 其次为地下生物量, 地上生物量最低。从对生物量的促进程度来看, 最合适的AM真菌种类为G. margarita, 对接种AM真菌响应最强的车轴草种类为T. alexandrinum。胁迫处理显著地增大了地上生物量的接种效应, 而降低了地下生物量的接种效应, 这表明胁迫时接种AM真菌更有利于地上生物量的增长, 这对AM真菌在重金属污染、干旱等胁迫下的农牧业实际中的应用具有重要意义。
接种AM真菌能够显著地增加车轴草属植物对氮的吸收, 且效应值最高, 与先前的研究相似[23, 24], 主要是AM真菌能够帮助植物吸收和同化氮素[25, 26, 27]。分组分析显示, 在不同分组中, 不同AM真菌种、车轴草属植物以及胁迫处理间其植物氮促进效应均无显著差异, 表明在不同条件下接种AM真菌对车轴草属植物的氮吸收都有强的促进效果。
AM真菌接种后能够显著地增加车轴草属植物对磷的吸收, 与以前研究结果相同, 因为AM真菌接种后能够扩大植物吸收磷的范围, 同时植物还能通过AM真菌菌丝转运吸收更多的磷[28, 29, 30]。分组分析显示, AM真菌种类和车轴草属植物种类都会对植物磷吸收造成显著性影响, 表明实际应用中应考虑植物种类和AM真菌种类的最佳组合, 继而最大的发挥AM真菌的促进作用。研究还发现胁迫处理对磷吸收不会产生显著影响, 这表明即使在胁迫条件下, AM真菌也能稳定的促进车轴草属植物对磷的吸收。
AM真菌接种后不能够增加车轴草属植物的钾吸收, 主要因为有32个样本来自G. intraradices接种, 而接种G. intraradices能够降低植物钾吸收[31]。AM真菌接种后能够显著增加车轴草属植物对钠的吸收, 这与部分研究结果[32, 33]不相同, 可能与车轴草属植物特异性钠吸收有关。AM真菌接种后能够显著增加车轴草属植物对锌的吸收, 与其他研究结果相同[34]。
通过Meta回归分析发现, 培养时间与植物总生物量、地上生物量、地下生物量、磷吸收以及钠吸收的接种效应之间无显著线性关系, 这表明AM真菌对这些指标的促进效果受培养时间长短影响不大; 而培养时间与植物氮吸收、钾吸收以及锌吸收的接种效应之间具有显著的正相关关系, 这表明AM真菌对车轴草属植物氮、钾以及锌元素的吸收促进作用具有时间上的叠加, 侵染共生时间越长, 促进作用越大。
本研究综合多篇文献结果, 通过Meta分析, 表明AM真菌能显著促进车轴草属植物生长以及营养吸收, 但其接种效应因不同的AM真菌种类、植物种类以及胁迫处理而不同。其中T. alexandrinum对接种AM真菌的响应最强; G. margarita对车轴草植物的生物量的促进作用最大; 胁迫处理能显著降低AM真菌接种效应; 培养时间能够显著的促进植物氮、钾以及锌吸收。本研究运用Meta分析方法研究了AM真菌对植物生长的影响, 其结论脱离了个例研究的单一性、偶然性, 具有强的综合性、普遍性, 亟需利用该方法展开更加深入的菌根学研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|